痛风
 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP body.skin-minerva .mw-parser-output table.infobox captiontext-align:center
| 謝博安症候群 | |
|---|---|
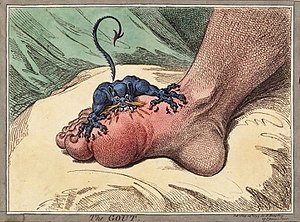 | |
晚年患上痛風的英國諷刺漫畫家詹姆斯·吉爾雷筆下的「痛風」 | |
| 分类和外部资源 | |
| 醫學專科 | 風濕病學 |
ICD-10 | M10 |
ICD-9-CM | 274.0 274.1 274.8 274.9 |
| OMIM | 138900 300323 |
| DiseasesDB | 29031 |
| eMedicine | med/924 orthoped/124 emerg/221 med/1112 oph/506 radio/313 |
| Patient UK | 痛风 |
| MeSH | D006073 |
痛風(英语:Gout,學名:metabolic arthritis),又稱代謝性關節炎。當涉及到跖趾關節時也稱為足痛風(Podagra)[1]。經常被描述為週期性發作的刺激性關節炎,造成關節紅、軟、熱、腫等現象[2]。劇烈疼痛通常在十二小時內就發作。大約一半的病例會影響到跖趾關節[3]。痛風也會導致痛風石、腎結石,或者急性尿酸腎病[4]。
導致痛風的原因結合了日常飲食和遺傳因素。痛風通常較容易發生在吃很多肉、喝很多啤酒或超重的人身上。潛在機制包含血液中尿酸水平的升高。當尿酸結晶後沉澱在關節、肌腱和周圍組織,就會形成痛風。痛風患者的關節液中能看見典型的尿酸結晶。血液中的尿酸水平有可能在痛風發作時恢復正常值[4]。
使用非類固醇消炎止痛藥、類固醇,或秋水仙素等藥物能改善痛風的症狀。患者透過改變生活方式使血液中尿酸水平下降能緩解急性痛風發作,而別嘌呤醇和丙磺舒兩種藥物能為那些頻繁的痛風發病者提供長期預防[4]。服用維生素C和食用低脂製品的飲食習慣也可能預防痛風的發生[5]。
大約百分之一到二的西方人口曾經或正在罹患痛風。近幾十年,人們認為由於人群中越來越多的風險因素,例如代謝綜合徵,較長的平均壽命和飲食上的改變,痛風的影響變得更普遍,其中年齡較長的男性是最普遍受影響的。至少追溯到古埃及時代,痛風在歷史上被公認為「國王病」或「富人病」[4][6]。
目录
1 症狀
2 病因
2.1 生活型態
2.2 基因型
2.3 健康狀況
2.4 用藥狀況
3 病理生理學
4 診斷
4.1 滑液
4.2 血液檢查
4.3 鑑別診斷
5 預防
6 治療
6.1 非類固醇消炎止痛藥
6.2 秋水仙素
6.3 類固醇
6.4 聚乙二醇重組尿酸酶
6.5 預防法
7 預後
8 流行病學
9 歷史
10 其他動物
11 相關研究
12 資料來源
13 外部連結
症狀
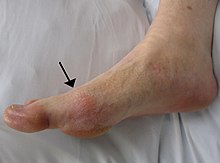
痛风出現在大脚趾的跖趾關節處,注意关节上皮肤的轻微红肿。
痛風會呈現出許多種症狀,最常見的是急劇的刺激性關節炎(關節紅,軟,熱和浮腫)[2]週期性地發作,而在腳拇趾基部的跖趾關節最常受影響,占一半的病例[3],原因可能是因為腳趾溫度較低,加上腳趾附近的液體會被身體吸收使尿酸濃度增加所造成。其他關節,例如腳踝、膝蓋、手腕和手指也有可能受影響[3]。關節疼痛通常在夜間發生且持續2到4個小時[3]。這有可能是由於體溫較低而產生[1],而晚上睡覺時,人體的抗炎物質促腎上腺皮質激素在半夜時分泌最少,加上睡眠時酸鹼值因體內累積二氧化碳而偏向酸性,因此痛風最易在半夜出現。其他的罕見症狀包含疲倦和高燒也有可能伴隨關節疼痛發生[1][3]。
血液中的尿酸濃度若長期偏高可能導致其他症狀,包含被稱為痛風結節的硬且無痛的尿酸結晶沉澱。由於骨骼侵蝕,大量的痛風結節可能導致慢性關節炎[7]。高的尿酸水平也可能引起腎臟中的晶體沉澱,導致腎結石以及隨後的急性尿酸腎病[8]。
病因
尿酸結晶是痛風的基本成因,而此結晶常常與血液中高尿酸濃度有關。包括飲食習慣、遺傳預先傾向性,以及腎臟對於尿酸鹽的清除率下降都可能造成高尿酸血症[2]。據統計,高尿酸血症大部分(約90%)都是患者腎臟對尿酸鹽清除率下降而造成的,而僅有不到10%的高尿酸血症病人是因體內產生過多的尿酸[4]。大約10%的高尿酸血症患者在人生中的某時刻病情進一步發展為痛風[9]。不過,每年患痛風的機率與血尿酸水平有關:當個體血尿酸濃度在415μmol/L和 530 μmol/L (7mg/dL 和 8.9 mg/dL)之間時,個體每年患痛風的機率為0.5%;而對於血尿酸濃度高於535 μmol/L (9 mg/dL)的個體,每年患痛風的機率為4.5%[1]。
生活型態
根據研究,飲食習慣因素佔痛風成因的12%[2],與酒精、添加果糖的飲料、肉類和海鮮類的攝取有很強的關聯性[7][10],而外傷和外科手術等等也和痛風有一定關係[4]。
在21世紀初的研究中發現,一些曾被認為與痛風相關的飲食實際上與痛風並無關聯[11][12]。像是適量的攝入嘌呤含量高的植物性食品(如豆子、豌豆、小扁豆、菠菜等)與痛風病情的發展並不相關[13],且蛋白質的總攝入量也與痛風無關[11][13]。飲用含酒精的飲料是導致痛風原因之一,特別是啤酒、烈酒和紅酒,导致病发風險更高[14]。
適量攝取咖啡、維他命C和奶製品,以及體格鍛煉可以減小得到痛風的風險[15][16][17],目前認為可能是這些食品能減少細胞發生胰島素抗性[17]。
基因型
痛風也與基因有一定的關係,60%的血尿酸濃度變化與基因有關[4]。SLC2A9、SLC22A12以及ABCG2三個基因被發現與痛風存在關聯性,而這三個基因的變異可將發病機率大致提高一倍[18][19]。SLC2A9 和 SLC22A12兩對等位基因的功能喪失型突變,會通過尿酸鹽吸收量的減少及失控的的尿酸鹽分泌而造成先天性高尿酸血癥[19]。少數罕見遺傳疾患可能是痛風的並發症,包括家族性少年高血尿酸癥腎病、髓質囊腎病、磷酸核糖焦磷酸合成酶的超活性化以及莱希-尼亨氏症候群中的次黃嘌呤-鳥嘌呤磷酸核苷轉移酶缺陷[4]。
健康狀況
痛風患者經常同時患上其他疾病。在約75%的病例中,腹部肥胖、高血壓、胰島素抵抗與血脂水平異常構成的代謝症候群與痛風同時發生[3]。痛風是紅血球過多症、鉛中毒、腎衰竭、溶血性貧血、牛皮癬等疾病,及器官移植的常見併發症[4][20]。若男性的身體質量指數(BMI)大於或等於35,其患痛風的機率則會增加兩倍[12]。因為鉛對腎功能有不利影響,長期暴露在含鉛環境中及飲用遭鉛污染的的酒也是痛風的致病因素[21]。莱希-尼亨氏症候群也常與痛風性關節炎有關。
用藥狀況
利尿劑的使用與痛風發作有關。但是低劑量的氫氯苯噻噠嗪(降血壓利尿劑)的使用並沒有增加患病風險的傾向[22]。菸鹼、阿司匹林(乙醯水楊酸)等其他藥物的使用也會增加痛風的患病機率[7]。免疫抑制劑環孢素和他克莫司的使用也與痛風的發病有關[4],若環孢素和氫氯苯噻噠嗪同時使用,則致病機率更大。[23]
病理生理學

尿酸
痛風是一種嘌呤代謝紊亂癥[4],發生在嘌呤代謝終產物尿酸以單鈉尿酸鹽形式結晶,沉澱並在關節、肌腱與周圍組織中形成沉澱物(即痛風石)[7]。微小的痛風石可能被一種環蛋白質清除,這些蛋白質可以阻礙晶體和細胞之間的交互作用,從而避免炎症反應的發生[24]。被蛋白質包裹的痛風石可能會因微小的關節外傷、藥物、手術應激或血尿酸水平的劇烈變化而將裸露的單鈉尿酸鹽晶體釋放[24]。痛風石釋放時,會引發局部免疫介導的炎性反應[7][24]。在炎症反應中,介白素1β是一種重要的蛋白質[4]的在人類和高級靈長類中,常見尿酸氧化酶(尿酸酶,即分解尿酸的酶)退化的情形[4]。
尿酸沉澱形成的誘因尚不完全明確。儘管尿酸也可在血尿酸濃度正常時結晶,但當血尿酸濃度升高時,尿酸結晶的可能性更大[7][25]。引起急性痛風性關節炎發作的其他重要因素包括低溫,以及血尿酸濃度、酸鹼度[26][27]、關節液成份、細胞外基質成分(例如蛋白聚糖、膠原蛋白,及硫酸軟骨素)的急速變化[4]。而尿酸在低溫下的沉澱量增加可以在一定程度上解釋為何痛風更容易發病於足部關節[2]。很多因素可引起尿酸濃度的急速變化,包括體外傷、手術、化療、使用利尿劑,以及開始服用或停用異嘌呤醇[1]。相對於其他治療高血壓的藥物,鈣離子通道阻斷劑及氯沙坦鉀(氫氯噻嗪)引起痛風發作的風險較小[28]。
診斷

X光片中左腳有痛風,位置在姆趾關節處,注意脚外侧缘的软组织也有肿胀

痛風伴隨著關節中尿酸結晶的構成,在偏振光顯微鏡下可從關節滑液取得尿酸結晶的圖片
痛風可能通過高尿酸血和典型的足痛風症狀而確診及治療,無需進一步檢查。但無法以臨床症狀確診時,患者需要進行關節滑液分析[1]。儘管X光在識別慢性痛風上有一定的臨床意義,但無法識別痛風的急性發作[4]。
滑液
痛風明確的診斷基於在關節滑液中辨認出單鈉尿酸鹽的結晶或痛風石[3]。所有通過關節穿刺術取得,來自未被確診發炎關節的滑液樣本,都需要進行這種結晶檢查[4]。在偏振光顯微鏡下,它們的形態為針狀且具有強烈的負性雙折射。這個檢驗不容易進行,常常需要受訓練過的醫檢師[29]因溫度和PH值會影響結晶的溶解度,滑液在抽吸出來后也必須被相當快速地檢驗[4]。
血液檢查
高尿酸血症也是典型的痛風特征,但近一半的痛風發作沒有伴隨高尿酸血症,且大多數人尿酸水平的升高不會發展成痛風[3][30],因此,測量尿酸水平的診斷功效是有限的[3]。高尿酸血症定義為男性血漿中尿酸鹽水平高於420 μmol/l(7.0 mg/dl)或女性血漿中尿酸鹽水平高於360 μmol/l(6.0 mg/dl)[31]。其他血檢通常是白細胞計數、電解質、腎功能及紅細胞沉降率。然而,白細胞計數和紅細胞沉降率的升高都可能是由於痛風而不是感染[32][33]。曾有記錄因痛風白細胞計數高至40×109/L(40000 /mm3)[1]。
鑑別診斷
醫師在對痛風的鑑別診斷中,最重要的是將敗血病關節炎納入考量[3][4],特別是在患者有感染症狀或治療效果不佳時[3]。為幫助醫師診斷,實驗室需進行滑液的革蘭氏染色及培養[3]。痛風也與假性痛風和類風濕性關節炎症狀相似[3]。痛風石可被誤認為是基底細胞癌或是其他腫瘤,特別是當痛風石並不位於關節時[34][35]。
預防
生活型態的改變與用藥皆能降低尿酸濃度。減少肉類與海鮮的攝取量、服用足量維生素C、控制醇類與果糖的攝取量,以及避免肥胖症都是有效的飲食與生活型態[2]低卡路里的飲食可以使肥胖男性之尿酸濃度降低100 微升/升(1.7 毫克/分升)[22]每日攝取1500 毫克的維生素 C可以降低45%的痛風風險[36]。喝咖啡可降低痛風風險,但茶類不行[37]痛風可能是由於睡眠呼吸中止症缺乏氧氣的細胞釋放嘌呤所導致的。對睡眠呼吸中止症的治療可以降低痛風的發生[38]。
治療
最初的治療目標為紓解急性痛風的症狀。不同的藥物可以降低血清的尿酸濃度而避免重複發作[39]。初步的證據顯示每天數次冰敷20至30分鐘可以減緩疼痛[40]。急性痛風的處方有非類固醇消炎止痛藥(NSAIDs)、秋水仙素與類固醇[2]。而預防用藥有別嘌呤醇、福避痛與丙璜舒。降低尿酸濃度可以治療痛風。對合併症的治療也十分重要[4]。以改變生活型態為治療的方式尚未被明確研究[40][41],營養品是否對痛風病患有影響也尚未知曉[42]。
非類固醇消炎止痛藥
非類固醇消炎止痛藥(NSAIDs)是治療痛風的一線藥物,且不同的非類固醇消炎止痛藥對痛風的療效都差不多,沒有特別有效的藥物[2]。用藥後痛風症狀可在四小時內緩解,不過一般建議病患持續用藥一至兩周[2][4]。但對於患有消化道出血、腎功能衰竭、心衰竭的病患,不推薦以非類固醇消炎止痛藥來治療痛風[43]。儘管歷史上吲哚美辛是最廣泛使用來治療痛風的非類固醇消炎止痛藥,但也推薦使用擁有差不多療效且較熟知其副作用的布洛芬做為治療痛風的藥物[22]。對於可能出現胃部副作用的患者,可以在使用非類固醇消炎止痛藥的同時服用氫離子幫浦阻斷劑[44]。有些研究證據顯示以COX-2抑制劑治療急性痛風可以與非類固醇消炎止痛藥同樣達到相同的療效,且擁有更低的副作用發生率[45][46]。
秋水仙素
對於那些不能使用非類固醇消炎止痛藥的人而言,秋水仙素能成為它的替代藥物。不過在使用高劑量秋水仙素時產生的腸胃道不適限制了它的使用[47]。但就低劑量使用而言,它仍然有不錯的效果,且具備較好的耐受性[22][48]。秋水仙素會與常用的處方藥(如阿托伐他汀、紅黴素等)產生交互作用[47]。
類固醇
已知糖皮質激素是和非類固醇消炎止痛藥擁有差不多藥效的藥物[49][50],因此若是患者不適合使用非類固醇消炎止痛類藥物,那麼糖皮質激素將是個好選擇[2]。對於痛風,關節注射糖皮質激素同樣有效,但若關節已被感染,注射糖皮質激素反而會使狀況更糟[2]。
聚乙二醇重組尿酸酶
聚乙二醇重組尿酸酶於2010年在美國通過核准正式上市[51],它能用於對傳統治療藥物無效的百分之三患者身上[51]。聚乙二醇重組尿酸酶在使用上是以靜脈注射作為途徑,每兩個星期需施打一次[51]。根據實驗,它不僅能夠溶解痛風石,還被發現能有效降低痛風患者的尿酸[52]。不過聚乙二醇重組尿酸酶雖然有還不錯的療效,但出現副作用的機率卻很高[53]。
預防法
許多藥物對於預防痛風進一步發作是有用的,例如黃嘌呤氧化酶抑制劑(包含異嘌呤醇及福避痛)和促進尿酸排泄藥物(如Probenecid,Sulfinpyrazone)。由於這些藥物理論上可能會使急診發作的症狀更加惡化,用藥的時間點通常在急性發作症狀緩解之後的一到兩週之後才開始[2],在開始用藥的頭三到六個月也常搭配治療急性發作的非類固醇性止痛藥與秋水仙素使用[4]。一般而言由於成本考量,痛風患者要發生過兩次以上的發作才會建議開始使用預防性用藥[2],但如果關節已經出現損傷、痛風石、或者是已經發生急性尿酸性腎病也會考慮投藥[8]。降尿酸藥物的劑量應該要調整到血清尿酸濃度介於300到600微莫耳/升(5.0到6.0毫克/公合),並終生服藥[2][4],但若發生急性發作則建議在發作期間暫時停藥[3]。如果血清尿酸濃度無法降到理想範圍且痛風重覆發作,這會被認定為治療失敗或是難治性痛風[54]。整體而言,異嘌呤醇在痛風治療上比probenecid來得有效[2]。
如果檢驗顯示尿酸排除不佳(通常是24小時尿液排除的總尿酸量低於800毫克),那麼促進尿酸排泄藥物會是比較好的選擇[55],但若患者有腎結石病史則不適合使用這類藥物[55]。如果24小時尿液排除的總尿酸量高於800毫克,這通常顯示尿酸排除的功能正常,但生產過多,這種時候黃嘌呤氧化酶抑制劑是較佳的選擇[55]。
黃嘌呤氧化酶抑制劑(包含異嘌呤醇及福避痛)會抑制尿酸合成,長期使用這類藥物目前被認為是安全且身體也能容忍長期用藥。腎功能不佳的患者或有尿酸結石的患者都可以使用黃嘌呤氧化酶抑制劑,但少數的人對於異嘌呤醇有過敏反應[2],這些人則應該使用福避痛做為替代用藥[56]。
預後
在沒接受治療的狀況下,急性痛風發作一般會在五到七天內緩解,但有六成的患者在一年內會第二次發作[1]。患有痛風的人罹患高血壓、糖尿病、代謝症候群、腎臟及心血管疾病的風險也比較高,也因此整體死亡風險相對於常人較高[4][57]。痛風與疾病風險的相關部分可能是因為痛風與胰島素抗性與肥胖症的關係,但也有部分的風險上升似乎是獨立的[57]。
如果不接受治療,急性痛風發作可能會惡化為慢性痛風並造成關節面損傷、關節變形、或是無痛性的痛風石[4]痛風患者如果在五年內不接受治療,產生痛風石的機會約為三成,通常會出現在耳殼、手肘的尺骨鷹嘴突、或是阿基里斯腱[4]。在接受積極治療後,痛風石可能會消失。腎結石也是痛風常見的併發症,約有一至四成的患者有這個問題,目前認為是由於尿液的酸鹼值偏酸,因而會促使尿酸在腎臟形成沉澱[4]。其他的慢性腎功能異常也可能出現在痛風患者身上[4]。尿酸也可能在腎臟結晶,或者是因長期服用止痛藥對肝腎造成的傷害,形成慢性腎衰竭。

在手指和耳轮的痛風石

膝关节的痛風石
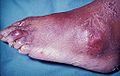
脚趾的痛风石,并延伸到外踝
痛风石破裂(渗出的尿酸结晶呈阳性)的痛风併發症
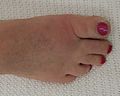
脚拇趾關節的痛風
流行病學
西方人終其一生有1到2%的人會患上痛風,而且這個比率正在上升[2][4]。從1990到2010年,痛風的發生率上升了將近兩倍[7],一般認為上升的原因包括壽命延長、飲食改變、以及與痛風相關的疾病的發生率上升(比方說代謝症候群和高血壓)[12]。有許多因素會影響痛風的發生率,包括年齡、種族、季節。在大於30歲的男性與50歲以上的女性族群中,痛風的盛行率為2%[43]。
在美國,非裔美國男性相對於歐裔美國人而言有兩倍的機會患上痛風[58],太平洋島國居民與紐西蘭的毛利人的痛風發生率也偏高,而澳洲原住民雖然血中尿酸濃度平均較高,但發生率卻不高[59]。在中國、玻里尼西亞、撒哈拉沙漠以南的都會區,痛風的發生率也都在上升[4]。有些研究指出痛風急性發作好發於春季,這可能是飲食習慣隨季節改變、酒精攝取量、運動量或是氣溫的改變造成[60]。有關台灣的情形,根據國家衛生研究院的研究,台灣的痛風盛行率約為2%至3%,約為歐美國家的十倍左右[61]。
歷史

安東尼·范·列文虎克在1679年初次描述了尿酸結晶在顯微鏡下的結構[62]
痛風古稱「王者之疾」、「帝王病」[4][63]或「富貴病」[6],因為此症好發在達官貴人的身上,如元世祖忽必烈晚年就因飲酒過量而飽受痛風之苦,使他無法走路和騎馬領兵上陣。頗為有趣的一點是在歷史上,患上痛風曾一度被認為是一種社會嚮往的疾病,因為只有達官貴人,有權有勢的上流社會人士才有機會患上痛風(高尿酸飲食多數只有富人才負擔得起)[64]。
「痛風」一詞最早出現在南北朝時期梁代陶弘景《名醫別錄》「獨活,微溫,無毒。主治諸賊風,百節痛風無久新者。[65]」因其疼痛來得快如一陣風,故由此命名。古代又稱「痛痹」,明朝虞摶所著《醫學正傳》卷四云:「夫古之所謂痛痹者,即今之痛風也。諸方書又謂之白虎歷節風,以其走痛于四肢骨節,如虎咬之狀,而以其名名之耳」。
世界其它地方亦有痛風疾病的古代紀錄,關於痛風的記載,最早可追溯到西元前2600年埃及關於大腳趾關節炎的記錄。古希臘名醫希波克拉底稱痛風為「不能步行的病」,並指出痛風是富者的關節炎,而風濕則是貧者的關節炎。在他的《格言》中,他對痛風下了以下的結論:「太監不會得到痛風,女人在更年期以後才會得到痛風,痛風的發炎在發生後40天內就會消退,痛風在春秋兩季較會發生。」[62][66][67]。
凱爾蘇斯在西元30年則描述了痛風與酒精和腎病的關聯,並發現在女性身上痛風會相對晚發作的現象:
……濃厚的尿液中有白色的沉澱物顯示疼痛與疾病潛藏在臟器與關節……在手與腳的關節問題很常見並且會持續發生(手部痛風稱為cheiragra,足部則稱為podagra)。這種疾病甚少影響宦官與童子之身的男孩,也不常在女性身上看到,除非他們的月事已經停止……有些患者在戒酒與禁慾後,此病一生不再發作。[68]
西元三世紀,羅馬醫師蓋倫首次描述痛風石(尿酸鹽)。「痛風」的英文gout則是在西元1200年,由一位名叫Randolphus of Bocking的一名修士發明,它來自於拉丁文的gutta,指的是一滴液體[62]。命名的理由是中世紀的醫學概念體液學說,認為痛風是由於血液中的病態物質「滴」到關節內部與周圍造成[69]。
英國醫師湯瑪斯·席登漢在1683年描述痛風容易在清晨發作,並好發於老年男性:
痛風患者一般是老年男性,或是那些過於操勞以致於身體未老先衰的男性(當中最常見的是沉緬於對酒精無限制的慾望中者,或是投身其他令人疲憊的熱情中)。患者通常在良好的狀態下入睡,但在約凌晨兩點就會因為腳拇趾的劇痛而醒來,有時候疼痛也會發生在腳跟、腳踝或是腳背,但較為少見。痛風的疼痛類似脫臼加上冰水淋在患部上,然後緊接而來的是寒顫與低燒……夜晚在折磨與無眠中消磨,不斷翻動著疼痛的部位與改變姿勢,疼痛與身體不斷的翻動都不會停止,並不斷惡化。[70]
荷蘭科學家安東尼·范·列文虎克在1679年初次描述了尿酸結晶在顯微鏡下的結構[62]。到了1848年,英國醫師阿弗列德·巴靈·加洛德發現血中過多的尿酸會導致痛風[71]。
其他動物
由於其他動物能合成尿酸氧化酶來分解尿酸,痛風在其他動物身上並不常見[72]。人類與其他人科動物無法合成這種酵素,因此在這些生物身上常見到痛風的發生[1][72]。魚類、兩棲動物與其他非靈長目動物能合成尿酸氧化酶[73]。有一個被命名為蘇的暴龍被認為在生前患有痛風[74]。
相關研究
目前有數種針對痛風的新藥正在開發中,包括anakinra(白細胞介素1族受體拮抗劑))、canakinumab(抗IL-1B抗體)、以及rilonacept(白細胞介素1族抑制劑)[75]。Canakinumab可能比低劑量的類固醇效果更佳,但價位是類固醇的五千倍[76]。合成尿酸氧化酶(Rasburicase)雖可行,但它的用途很有限,因為它會誘發自體免疫反應,目前正在開發較不會誘發免疫反應版本的合成尿酸氧化酶[1]。
資料來源
^ 1.01.11.21.31.41.51.61.71.81.9 Eggebeen AT. Gout: an update. Am Fam Physician. 2007, 76 (6): 801–8. PMID 17910294.
^ 2.002.012.022.032.042.052.062.072.082.092.102.112.122.132.142.152.16 Chen LX, Schumacher HR. Gout: an evidence-based review. J Clin Rheumatol. October 2008, 14 (5 Suppl): S55–62. PMID 18830092. doi:10.1097/RHU.0b013e3181896921.
^ 3.003.013.023.033.043.053.063.073.083.093.103.113.123.13 Schlesinger N. Diagnosing and treating gout: a review to aid primary care physicians. Postgrad Med. March 2010, 122 (2): 157–61. PMID 20203467. doi:10.3810/pgm.2010.03.2133.
^ 4.004.014.024.034.044.054.064.074.084.094.104.114.124.134.144.154.164.174.184.194.204.214.224.234.244.254.264.274.284.29 Richette P, Bardin T. Gout. Lancet. January 2010, 375 (9711): 318–28. PMID 19692116. doi:10.1016/S0140-6736(09)60883-7.
^ Questions and Answers about Gout. National Institute of Arthritis and Musculoskeletal and Skin Diseases. June 2015 [2 February 2016].
^ 6.06.1 Rich Man's Disease – definition of Rich Man's Disease in the Medical dictionary. Free Online Medical Dictionary, Thesaurus and Encyclopedia.
^ 7.07.17.27.37.47.57.6 Terkeltaub R. Update on gout: new therapeutic strategies and options. Nature Reviews Rheumatology. January 2010, 6 (1): 30–8. PMID 20046204. doi:10.1038/nrrheum.2009.236.
^ 8.08.1 Tausche AK, Jansen TL, Schröder HE, Bornstein SR, Aringer M, Müller-Ladner U. Gout—current diagnosis and treatment. Dtsch Arztebl Int. August 2009, 106 (34–35): 549–55. PMC 2754667. PMID 19795010. doi:10.3238/arztebl.2009.0549.
^ Vitart V, Rudan I, Hayward C, 等. SLC2A9 is a newly identified urate transporter influencing serum urate concentration, urate excretion and gout. Nat. Genet. April 2008, 40 (4): 437–42. PMID 18327257. doi:10.1038/ng.106.
^ Weaver, AL. Epidemiology of gout. Cleveland Clinic journal of medicine. July 2008,. 75 Suppl 5: S9–12. PMID 18819329. doi:10.3949/ccjm.75.Suppl_5.S9.
^ 11.011.1 Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N. Engl. J. Med. March 2004, 350 (11): 1093–103. PMID 15014182. doi:10.1056/NEJMoa035700.
^ 12.012.112.2 Weaver AL. Epidemiology of gout. Cleve Clin J Med. 2008,. 75 Suppl 5: S9–12. PMID 18819329. doi:10.3949/ccjm.75.Suppl_5.S9.
^ 13.013.1 Singh, JA; Reddy, SG; Kundukulam, J. Risk factors for gout and prevention: a systematic review of the literature.. Current opinion in rheumatology. March 2011, 23 (2): 192–202. PMID 21285714. doi:10.1097/BOR.0b013e3283438e13.
^ Roddy, Edward. Gout. BMJ. Oct 1, 2013, 347: f5648. doi:10.1136/bmj.f5648.
^ Hak AE, Choi HK. Lifestyle and gout. Curr Opin Rheumatol. March 2008, 20 (2): 179–86. PMID 18349748. doi:10.1097/BOR.0b013e3282f524a2.
^ Williams PT. Effects of diet, physical activity and performance, and body weight on incident gout in ostensibly healthy, vigorously active men. Am. J. Clin. Nutr. May 2008, 87 (5): 1480–7. PMID 18469274.
^ 17.017.1 Choi HK. A prescription for lifestyle change in patients with hyperuricemia and gout. Curr Opin Rheumatol. March 2010, 22 (2): 165–72. PMID 20035225. doi:10.1097/BOR.0b013e328335ef38.
^ Merriman, TR; Dalbeth, N. The genetic basis of hyperuricaemia and gout.. Joint, bone, spine : revue du rhumatisme. 2011, 78 (1): 35–40. PMID 20472486. doi:10.1016/j.jbspin.2010.02.027.
^ 19.019.1 Reginato AM, Mount DB, Yang I, Choi HK. The genetics of hyperuricaemia and gout. Nature Reviews Rheumatology. 2012, 8 (10): 610–21. PMC 3645862. PMID 22945592. doi:10.1038/nrrheum.2012.144.
^ Stamp L, Searle M, O'Donnell J, Chapman P. Gout in solid organ transplantation: a challenging clinical problem. Drugs. 2005, 65 (18): 2593–611. PMID 16392875. doi:10.2165/00003495-200565180-00004.
^ Loghman-Adham M. Renal effects of environmental and occupational lead exposure. Environ. Health Perspect. (Brogan & Partners). September 1997, 105 (9): 928–38. JSTOR 3433873. PMC 1470371. PMID 9300927. doi:10.2307/3433873.
^ 22.022.122.222.3 Laubscher T, Dumont Z, Regier L, Jensen B. Taking the stress out of managing gout. Can Fam Physician. December 2009, 55 (12): 1209–12. PMC 2793228. PMID 20008601.
^ Firestein, MD, Gary S.; Budd, MD, Ralph C.; Harris Jr., MD, Edward D.; McInnes PhD, FRCP, Iain B.; Ruddy, MD, Shaun; Sergent, MD, John S. (编). Chapter 87: Gout and Hyperuricemia. Kelley's Textbook of Rheumatology 8th. Elsevier. 2008. ISBN 978-1-4160-4842-8.
^ 24.024.124.2 Liu-Bryan, Ru; Terkeltaub, Robert. Evil humors take their Toll as innate immunity makes gouty joints TREM-ble. Arthritis & Rheumatism. 2006, 54 (2): 383–386. doi:10.1002/art.21634.
^ Virsaladze DK, Tetradze LO, Dzhavashvili LV, Esaliia NG, Tananashvili DE. [Levels of uric acid in serum in patients with metabolic syndrome] [Levels of uric acid in serum in patients with metabolic syndrome]. Georgian Med News. 2007, (146): 35–7. PMID 17595458 (俄语).
^ Moyer RA, John DS. Acute gout precipitated by total parenteral nutrition. The Journal of rheumatology. 2003, 30 (4): 849–50. PMID 12672211.
^ Halabe A, Sperling O. Uric acid nephrolithiasis. Mineral and electrolyte metabolism. 1994, 20 (6): 424–31. PMID 7783706.
^ Choi HK, Soriano LC, Zhang Y, Rodríguez LA. Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study. BMJ. 2012, 344: d8190. PMC 3257215. PMID 22240117. doi:10.1136/bmj.d8190.
^ Schlesinger N. Diagnosis of gout. Minerva Med. 2007, 98 (6): 759–67. PMID 18299687.
^ Sturrock R. Gout. Easy to misdiagnose. BMJ. 2000, 320 (7228): 132–33. PMC 1128728. PMID 10634714. doi:10.1136/bmj.320.7228.132.
^ Sachs L, Batra KL, Zimmermann B. Medical implications of hyperuricemia. Med Health R I. 2009, 92 (11): 353–55. PMID 19999892.
^ Gout: Differential Diagnoses & Workup – eMedicine Rheumatology. Medscape.
^ Gout and Pseudogout: Differential Diagnoses & Workup – eMedicine Emergency Medicine. Medscape.
^ Jordan DR, Belliveau MJ, Brownstein S, McEachren T, Kyrollos M. Medial canthal tophus. Ophthal Plast Reconstr Surg. 2008, 24 (5): 403–4. PMID 18806664. doi:10.1097/IOP.0b013e3181837a31.
^ Sano K, Kohakura Y, Kimura K, Ozeki S. Atypical Triggering at the Wrist due to Intratendinous Infiltration of Tophaceous Gout. Hand (N Y). March 2009, 4 (1): 78–80. PMC 2654956. PMID 18780009. doi:10.1007/s11552-008-9120-4.
^ Choi HK, Gao X, Curhan G. Vitamin C intake and the risk of gout in men: a prospective study. Arch. Intern. Med. March 2009, 169 (5): 502–7. PMC 2767211. PMID 19273781. doi:10.1001/archinternmed.2008.606.
^ Choi HK, Curhan G. Coffee, tea, and caffeine consumption and serum uric acid level: the third national health and nutrition examination survey. Arthritis Rheum. June 2007, 57 (5): 816–21. PMID 17530681. doi:10.1002/art.22762.
^ Abrams B. Gout is an indicator of sleep apnea. Sleep. 2005, 28 (2): 275. PMID 16171252.
^ Zhang W, Doherty M, Bardin T, 等. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann. Rheum. Dis. October 2006, 65 (10): 1312–24. PMC 1798308. PMID 16707532. doi:10.1136/ard.2006.055269.
^ 40.040.1 Moi, JH; Sriranganathan, MK; Edwards, CJ; Buchbinder, R. Lifestyle interventions for acute gout. The Cochrane database of systematic reviews. 4 November 2013, 11: CD010519. PMID 24186771. doi:10.1002/14651858.CD010519.pub2.
^ Moi, JH; Sriranganathan, MK; Edwards, CJ; Buchbinder, R. Lifestyle interventions for chronic gout.. The Cochrane database of systematic reviews. 31 May 2013, 5: CD010039. PMID 23728699. doi:10.1002/14651858.CD010039.pub2.
^ Andrés, M; Sivera, F; Falzon, L; Buchbinder, R; Carmona, L. Dietary supplements for chronic gout.. The Cochrane database of systematic reviews. Oct 7, 2014, 10: CD010156. PMID 25287939. doi:10.1002/14651858.CD010156.pub2.
^ 43.043.1 Winzenberg T, Buchbinder R. Cochrane Musculoskeletal Group review: acute gout. Steroids or NSAIDs? Let this overview from the Cochrane Group help you decide what's best for your patient. J Fam Pract. 2009, 58 (7): E1–4. PMID 19607767.
^ Clinical Knowledge Summaries. Gout – Management – What treatment is recommended in acute gout?. U.K. National Library for Health. [2008-10-26].
^ van Durme, CM; Wechalekar, MD; Landewé, RB. Nonsteroidal anti-inflammatory drugs for treatment of acute gout.. JAMA. 9 June 2015, 313 (22): 2276–7. PMID 26057289. doi:10.1001/jama.2015.1881.
^ van Durme, CM; Wechalekar, MD; Buchbinder, R; Schlesinger, N; van der Heijde, D; Landewé, RB. Non-steroidal anti-inflammatory drugs for acute gout.. The Cochrane database of systematic reviews. 16 September 2014, 9: CD010120. PMID 25225849. doi:10.1002/14651858.CD010120.pub2.
^ 47.047.1 Information for Healthcare Professionals: New Safety Information for Colchicine (marketed as Colcrys). U.S. Food and Drug Administration.
^ van Echteld, I; Wechalekar, MD; Schlesinger, N; Buchbinder, R; Aletaha, D. Colchicine for acute gout.. The Cochrane database of systematic reviews. Aug 15, 2014, 8: CD006190. PMID 25123076. doi:10.1002/14651858.CD006190.pub2.
^ Man CY, Cheung IT, Cameron PA, Rainer TH. Comparison of oral prednisolone/paracetamol and oral indomethacin/paracetamol combination therapy in the treatment of acute goutlike arthritis: a double-blind, randomized, controlled trial. Annals of Emergency Medicine. 2007, 49 (5): 670–7. PMID 17276548. doi:10.1016/j.annemergmed.2006.11.014.
^ van Durme, CM; Wechalekar, MD; Buchbinder, R; Schlesinger, N; van der Heijde, D; Landewé, RB. Non-steroidal anti-inflammatory drugs for acute gout.. The Cochrane database of systematic reviews. Sep 16, 2014, 9: CD010120. PMID 25225849. doi:10.1002/14651858.CD010120.pub2.
^ 51.051.151.2 FDA approves new drug for gout. FDA. September 14, 2010.
^ Sundy, JS; Baraf, HS, Yood, RA, Edwards, NL, Gutierrez-Urena, SR, Treadwell, EL, Vázquez-Mellado, J, White, WB, Lipsky, PE, Horowitz, Z, Huang, W, Maroli, AN, Waltrip RW, 2nd, Hamburger, SA, Becker, MA. Efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatment: two randomized controlled trials. JAMA: the Journal of the American Medical Association. Aug 17, 2011, 306 (7): 711–20. PMID 21846852. doi:10.1001/jama.2011.1169. 引文使用过时参数coauthors (帮助)
^ Sriranganathan, MK; Vinik, O; Bombardier, C; Edwards, CJ. Interventions for tophi in gout.. The Cochrane database of systematic reviews. Oct 20, 2014, 10: CD010069. PMID 25330136. doi:10.1002/14651858.CD010069.pub2.
^ Ali, S; Lally, EV. Treatment failure gout. Medicine and health, Rhode Island. November 2009, 92 (11): 369–71. PMID 19999896.
^ 55.055.155.2 Elizabeth D Agabegi; Agabegi, Steven S. Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. 2008: 251. ISBN 0-7817-7153-6.
^ Febuxostat for the management of hyperuricaemia in people with gout (TA164) Chapter 4. Consideration of the evidence. Guidance.nice.org.uk. [2011-08-20]. (原始内容存档于2010-10-06). 无效|dead-url=bot: unknown(帮助)
^ 57.057.1 Kim SY, De Vera MA, Choi HK. Gout and mortality. Clin. Exp. Rheumatol. 2008, 26 (5 Suppl 51): S115–9. PMID 19026153.
^ Rheumatology Therapeutics Medical Center. What Are the Risk Factors for Gout?. [2007-01-26]. (原始内容存档于2007-03-25).
^ Roberts-Thomson RA, Roberts-Thomson PJ. Rheumatic disease and the Australian aborigine. Ann. Rheum. Dis. May 1999, 58 (5): 266–70. PMC 1752880. PMID 10225809. doi:10.1136/ard.58.5.266.
^ Fam AG. What is new about crystals other than monosodium urate?. Curr Opin Rheumatol. May 2000, 12 (3): 228–34. PMID 10803754. doi:10.1097/00002281-200005000-00013.
^ 全民健康基金會 痛風 痛起來真要命!
^ 62.062.162.262.3 Pillinger, MH; Rosenthal P; Abeles AM. Hyperuricemia and gout: new insights into pathogenesis and treatment. Bulletin of the NYU Hospital for Joint Diseases. 2007, 65 (3): 215–221. PMID 17922673. (原始内容存档于2008-12-16).
^ The Disease Of Kings - Forbes.com. Forbes.
^ 耿相新著. 忽必烈汗. 中國: 知書房. 1992年. ISBN 9789578622005.
^ 急性痛風性關節炎的中醫研究進展 页面存档备份,存于互联网档案馆
^ The Internet Classics Archive Aphorisms by Hippocrates. MIT. [July 27, 2010].
^ George, N; PA Simkin. A concise history of gout and hyperuricemia and their treatment. Arthritis Research and Therapy. 2006, 8 (Suppl 1): S1 [2011-01-21]. 引文使用过时参数coauthors (帮助)(英文)
^ A. Cornelius Celsus. On Medicine. University of Chicago. Book IV.
^ gout, n.1.. Oxford English Dictionary, Second edition, 1989. [18 September 2011].
^ Gout – The Affliction of Kings. h2g2. BBC. December 23, 2012.
^ Storey GD. Alfred Baring Garrod (1819–1907). Rheumatology (Oxford, England). October 2001, 40 (10): 1189–90. PMID 11600751. doi:10.1093/rheumatology/40.10.1189.
^ 72.072.1 Agudelo CA, Wise CM. Gout: diagnosis, pathogenesis, and clinical manifestations. Curr Opin Rheumatol. 2001, 13 (3): 234–9. PMID 11333355. doi:10.1097/00002281-200105000-00015.
^ Choi, HK; Mount, DB; Reginato, AM; American College of, Physicians; American Physiological, Society. Pathogenesis of gout.. Annals of Internal Medicine. 4 October 2005, 143 (7): 499–516. PMID 16204163. doi:10.7326/0003-4819-143-7-200510040-00009.
^ Rothschild, BM; Tanke D; Carpenter K. Tyrannosaurs suffered from gout. Nature. 1997, 387 (6631): 357. PMID 9163417. doi:10.1038/387357a0.
^ Abeles, A. M. and Pillinger, M. H. New therapeutic options for gout here and on the horizon. Journal of Musculoskeletal Medicine. March 8, 2010. (原始内容存档于2010年5月20日).
^ Sivera, F; Wechalekar, MD; Andrés, M; Buchbinder, R; Carmona, L. Interleukin-1 inhibitors for acute gout.. The Cochrane database of systematic reviews. Sep 1, 2014, 9: CD009993. PMID 25177840. doi:10.1002/14651858.CD009993.pub2.
外部連結
- 《民眾日報》2009年5月12日報導:遠離痛風_奇美醫師:別信偏方,轉述PChome新聞。
- 疾病飲食系列/痛風
- 雙氯芬酸鈉
开放式目录计划中和痛风相关的内容
|




