腈
 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP
氰基的结构: 官能团被突出为蓝色.
腈[註 1](英语:nitrile),指的是带有C≡N官能团的有机化合物[2]。
C≡N基团称作氰基,在 -CN 基团中碳原子和氮原子通过三键键合在一起。无机化学中带有此官能团者為氰,而不称“腈”。[3]
许多含氰基的化合物都具有高毒性。
目录
1 历史
2 合成
3 反应
3.1 水解反应
3.2 还原反应
3.3 亲核反应
3.4 烷基化反应
3.5 杂记
4 有机氨基腈
5 腈氧化物
6 参见
7 注釋
8 参考文献
9 外部链接
历史
氢氰酸首次由卡尔·威廉·舍勒于1782年成功合成。[4] 1811年,由约瑟夫·路易·盖-吕萨克合成出纯净的氢氰酸,这是一种剧毒且具挥发性的酸。氰基苯甲酸首先由弗里德里希·维勒和尤斯图斯·冯·李比希合成,但是由于当时的合成收率很低结果没有得到其理化数据,也没有得到它的假定结构。泰奥菲勒-朱尔·皮乐茨于1834年合成出了丙腈并且假设此化合物是一个含有氢氰酸的醚类化合物。[5]Hermann Fehling于1844年通过加热苯甲酸铵合成了苯腈,这是首个获得足够量以用于化学研究合成方法。
他通过加热甲酸铵的结果比对得到的物质以确定该结构。他为该新发现的化合物命名为腈,而这也成为了官能团的名称。[6]
合成
工业中, 主要合成腈的方法是氨氧化和氢氰化。这两种路线都符合绿色化学,因为在反应中不会产生等当量的盐。在氨氧化反应中,烃分子在氨的存在下被部分氧化,这个转化被用于大量的合成丙烯腈。[7]
- CH3CH=CH2 + 3/2 O2 + NH3 → NCCH=CH2 + 3 H2O
利用氢氰酸从1,3-丁二烯合成己二腈的例子:
- CH2=CH-CH=CH2 + 2 HCN → NC(CH2)4CN
在许多特殊的应用中,腈还可以通过下列方法进行合成:
脂肪族亲核取代反应:在Kolbe腈合成中,卤代烃和金属氰化物(氰盐)反应。芳香腈通过Rosenmund-von Braun合成法制备。- 通过一级酰胺的脱水制备腈。许多试剂都可以用来作为脱水试剂:二氯磷酸甲酯和DBU的组合试剂就是其中的一种。
图例为苯甲酰胺转化为苯甲腈:[8]

酰胺的脱水反应
- 反应中的两个中间体是酰胺的互变异构体A,以及它的磷酸酯B。
- 通过二级酰胺的脱水(von Braun酰胺降解反应)合成腈。
醛肟、三乙胺/二氧化硫、沸石或者硫酰氯的脱水合成腈。
醛、羟胺和硫酸钠通过一锅法合成腈。
- 图例为一项研究中,一个芳香或脂肪醛和羟氨、无水硫酸钠在无溶剂反应中,通过微波反应历经肟中间体合成腈化合物。[9]

醛由一锅法制备腈
- 从芳香羧酸合成腈(Letts腈合成)。
- 在Sandmeyer反应中,芳香腈从偶氮化合物合成。
- 一个引入氰基的商业化试剂:氰基二乙基铝(Et2AlCN)可以通过三乙基铝和HCN合成。[10].这个试剂被用于对酮类的亲核加成反应。[11] 例如其应用:Kuwajima紫杉醇全合成。
- 氰离子很容易让二溴化合物发生偶联反应。α,α'-二溴己二酸与氰化钠在乙醇当中反应得到氰基环丁烷:[12]

氰基诱导的偶联反应
- 在Franchimont反应(A. P. N. Franchimont,1872年)中,一个α-溴代羧酸在氰基水解和脱羧反应后发生了二聚反应。[13]
- 芳香腈可以通过三氯甲基芳基亚胺(RC(CCl3)=NH)的碱性水解来合成,即Houben-Fischer合成。[14][15]
反应
氰基基团可以在不同的的条件和试剂中进行不同的反应,包括:水解反应、氢化反应、还原反应或者成为离去基团(氰基)而进行取代反应。
水解反应
水解腈RCN在酸性或者碱性条件下会经过不同的水解历程,得到酰胺 RC(=O)NH2然后继续水解再得到羧酸RCOOH。腈的水解被普遍认为是制备羧酸的最佳方法之一。然而这些酸、碱催化的反应对于制备酰胺都有一定的局限性。主要的局限性在于:无论是酸或碱催化的反应,最终中和过程会导致大量的氰盐生成,从而引起污染问题。
腈完全水解的方程式为:[16]
- RCN + 2 H2O + HCl —Δ→ RCOOH + NH4Cl
- RCN + H2O + 2 NaOH —Δ→ RCOONa + NH3
还原反应
在有机还原反应中,腈通过氢气和镍催化剂进行还原,产物是一个氨。(参见腈的还原)。腈还原成亚胺然后进行水解反应得到醛,即Stephen醛合成。
亲核反应
氰基碳原子是一个亲核中心,因此可以发生亲核加成反应:
- 和有机锌化合物发生Blaise反应。
- 和醇发生Pinner反应。
- 类似的反应:胺、肌氨酸和氨腈反应得到肌酸。[17]
- 腈通过Houben-Hoesch反应得到酮,该反应机理就是Friedel-Crafts酰化反应。
烷基化反应
去质子的氰基能作为强有力的亲核试剂而用于烷基化亲电试剂,这里关键在于氰基离子 CN 的较小位阻和它独特的稳定性。这些特性都使得高位阻碳-碳键的合成可以理想的通过腈中间体来达成,因此腈中间体广泛的应用于合成药物靶分子和医药原料。[18]
杂记
- 在还原去氰基反应(reductive decyanation)中,氰基被氢原子取代。[19] 如:用HMPA和金属钾在叔丁醇中发生溶解金属还原反应。α-氨基腈可以通过四氢锂铝去氰基。
- 腈在碱性条件下可以发生自身的亲核加成反应,即Thorpe反应。
- 在有机金属化学中,腈对炔烃进行加成反应,称为碳氰化反应(carbocyanation):[20]

碳氰化反应 Nakao 2007
有机氨基腈
氨基腈(Cyanamides)是一种N-氰基的化合物,具有通式:R1R2N-CN,它相似于无机化合物氰胺(cyanamide)。
腈氧化物
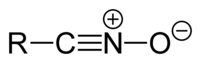
腈氧化物具有通式R-CNO。
参见
- 官能团
- 氰基
- 腈的聚合物,如丁腈橡胶可以用来制作安全手套。
- 质子化腈:腈鎓
- 去质子氰:氰负离子
- 异腈
- 氰碳原子
- 氰叶立德
- 腈钠
注釋
^ 拼音:jīng
参考文献
^ 《化學命名原則》第四版第167頁
^ IUPAC Gold Book nitriles
^ NCBI-MeSH Nitriles
^ David T. Mowry. The Preparation of Nitriles ([失效連結] – Scholar search). Chemical Reviews. 1948, 42 (2): 189–283. doi:10.1021/cr60132a001. [永久失效連結]
^ J. Pelouze. Notiz über einen neuen Cyanäther. Annalen der Chemie und Pharmacie. 1834, 10 (2): 249. doi:10.1002/jlac.18340100302.
^ Hermann Fehling. Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme. Annalen der Chemie und Pharmacie. 1844, 49 (1): 91–97. doi:10.1002/jlac.18440490106.
^ Peter Pollak, Gérard Romeder, Ferdinand Hagedorn, Heinz-Peter Gelbke "Nitriles" Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_363
^ Chun-Wei Kuo, Jia-Liang Zhu, Jen-Dar Wu, Cheng-Ming Chu, Ching-Fa Yao and Kak-Shan Shia. A convenient new procedure for converting primary amides into nitriles. Chem. Commun. 2007, 2007 (3): 301–303. PMID 17299646. doi:10.1039/b614061k.
^ Sharwan K, Dewan, Ravinder Singh, and Anil Kumar. One pot synthesis of nitriles from aldehydes and hydroxylamine hydrochloride using sodium sulfate (anhyd) and sodium bicarbonate in dry media under microwave irradiation (open access). Arkivoc. 2006: (ii) 41–44.
^ W. Nagata and M. Yoshioka (1988). "Diethylaluminum cyanide". Org. Synth.; Coll. Vol. 6: 436.
^ W. Nagata, M. Yoshioka, and M. Murakami (1988). "PREPARATION OF CYANO COMPOUNDS USING ALKYLALUMINUM INTERMEDIATES: 1-CYANO-6-METHOXY-3,4-DIHYDRONAPHTHALENE". Org. Synth.; Coll. Vol. 6: 307.
^ Reynold C. Fuson, Oscar R. Kreimeier, and Gilbert L. Nimmo. Ring Closures In The Cyclobutane Series. Ii. Cyclization Of Α,Α′-Dibromo-Adipic Esters. J. Am. Chem. Soc. 1930, 52 (10): 4074–4076. doi:10.1021/ja01373a046.
^ Franchimont Reaction
^ Über eine neue Methode zur Darstellung cyclischer Nitrile durch katalytischen Abbau (I. Mitteil.) (p 2464-2472) J. Houben, Walter Fischer Berichte der deutschen chemischen Gesellschaft (A and B Series)
Volume 63, Issue 9 , Pages 2464 - 2472 doi:10.1002/cber.19300630920
^ http://www.drugfuture.com/OrganicNameReactions/ONR197.htm Merck & Co., Inc., Whitehouse Station
^ 羧酸的制备——腈水解. 北京中医药大学远程教育学院
^ Smith, Andri L.; Tan, Paula. Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment. J. Chem. Educ. 2006, 83: 1654. doi:10.1021/ed083p1654.
^ Tetrahedron Volume 61, Issue 4, 24 January 2005, Pages 747-789 doi:10.1016/j.tet.2004.11.012
^ The reductive decyanation reaction: chemical methods and synthetic applications Jean-Marc Mattalia, Caroline Marchi-Delapierre, Hassan Hazimeh, and Michel Chanon Arkivoc (AL-1755FR) pp 90-118 2006 Article
^ Yoshiaki Nakao, Akira Yada, Shiro Ebata, and Tamejiro Hiyama. A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes. J. Am. Chem. Soc. (Communication)使用|format=需要含有|url=(帮助). 2007, 129 (9): 2428–2429. PMID 17295484. doi:10.1021/ja067364x.
外部链接
(英文)國際純粹與應用化學聯合會."nitrile".《化学术语总目录》在线版.
(英文)國際純粹與應用化學聯合會."cyanide".《化学术语总目录》在线版.
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||