p軌域
 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP
 |  |  |  |  |
 |  |  |  |  |
 |  |  |  |  |
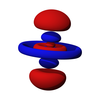
在化學與原子物理學中,p軌域(英语:p orbital)是一種原子軌域,其角量子數為1,其磁量子數可以為-1、0或+1,且每個殼層裡中有三個p軌域,Px、Py、Pz,形狀皆相同但方向不同,每個可以容納2個電子,因此,p軌域共可以容納6個電子。
p軌域是一個很穩定的軌域,其穩定性僅次於s軌域,為能量第二低的軌域,另外由於能階交錯,若以週期的角度來看,p軌域是能量最高的軌域,也是最後填滿的軌域,其電子出現機率密度的形象是啞鈴形,呈線性對稱,換句話說,p軌域是一個雙啞鈴形或吊鐘形的軌域。
目录
1 命名
2 結構
3 電子波
4 p軌域
5 p區元素
6 參見
7 參考文獻
命名
p軌域的「p」是「principal」,其為「主系光譜」之意。
結構

三種p軌域形狀一樣但方向不同

5p軌域模型,紅色和藍色中間空隙則為波節
p軌域從第二個殼層開始出現,最小的p軌域是2p軌域,也就是說,當主量子數n=1時,沒有p軌域(1p軌域不存在)。當角量子數l=1時,磁量子數m會有三種值,分別為1、0、-1,因此,自量子數n=2開始有三種p軌域對應於每一個主量子數,例如,當主量子數n=2時,p軌域分別為2px、2py和2pz軌域,每個軌域皆可分成兩葉,帶有不同的「正負性」,這是代表波函數量值的正負。大小則如同s軌域,p軌域的形狀在2p、3p、4p裡都相同,只是大小隨著主量子數的增加而增加。p軌域同樣存在波節面,如3p軌域在主要電子出現的兩葉中,有較小而與主葉分離的區域,此處電子出現概率為0,則這個區域即為p軌域的波節面,隨著主量子數的增加,波節的數量也會跟著增加。
電子波
三個p軌域的原子軌域角量子數ℓ=1。p軌域的三次諧波的表示法:
- pz=N1czr=Y10displaystyle p_z=N_1^cfrac zr=Y_1^0
- px=N1cxr=12(Y11−Y1−1)displaystyle p_x=N_1^cfrac xr=frac 1sqrt 2left(Y_1^1-Y_1^-1right)
- py=N1cyr=i12(Y11+Y1−1)displaystyle p_y=N_1^cfrac yr=ifrac 1sqrt 2left(Y_1^1+Y_1^-1right)
with
- N1c=(34π)1/2displaystyle N_1^c=left(frac 34pi right)^1/2
| pz | px | py |
|---|---|---|
 |  |  |
p軌域
在周期表中,每個周期元素的價殼層,p軌域是最後才填滿的軌域,直至18族,p軌域是全滿的。
p區元素
p區元素是指這些元素中具有最高能量的電子是填在p軌域上的,p區元素主要包括元素周期表中過度金屬右邊的元素,包含:
- IIIA族元素又稱為硼族元素
- IVA族元素又稱作碳族元素
- VA族元素又稱作氮族元素
- VIA族元素又稱為氧族元素
- VIIA族元素又稱鹵素
- VIIIA族元素或惰性氣體
參見
- s軌域
- d軌域
- 原子軌域
- p區元素
參考文獻
- 曾國輝《原子結構》建宏出版社 台北市 1999 ISBN 957-724-801-2
| ||||||||||||||||||||||||||