核糖核酸
 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP 
mRNA的球棍模型,其中灰色小球代表碳原子,紅色小球代表氧原子,藍色小球代表氮原子,橘色小球代表磷原子

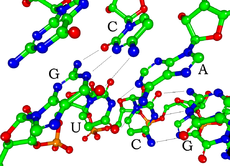
圖爲mRNA前體上的一段莖環結構。含氮鹼基以綠色表示,而磷酸-核糖骨架則以藍色表示。注意莖(雙鏈)結構是由一條RNA單鏈通過摺疊形成
核糖核酸(英语:Ribonucleic acid),簡稱RNA,是一類由核糖核苷酸通過3',5'-磷酸二酯鍵聚合而成的線性大分子[1]。自然界中的RNA通常是單鏈的,且RNA中最基本的四種鹼基爲A(腺嘌呤)、U(尿嘧啶)、G(鳥嘌呤)、C(胞嘧啶)[註 1],相對的,與RNA同爲核酸的DNA通常是雙鏈分子,且含有的含氮鹼基爲A(腺嘌呤)、T(胸腺嘧啶)、G(鳥嘌呤)、C(胞嘧啶)四種。
RNA有着多種多樣的功能,可在遺傳編碼、轉譯、調控、基因表達等過程中發揮作用。按RNA的功能,可將RNA分爲多種類型。比如,在細胞生物中,mRNA(傳訊RNA)爲遺傳訊息的傳遞者,它能夠指導蛋白質的合成。因爲mRNA有編碼蛋白質的能力,它又被稱爲編碼RNA。而其他沒有編碼蛋白質能力的RNA則被稱爲非編碼RNA(ncRNA)。它們經由催化生化反應,或透過調控或參與基因表達過程發揮相應的生理功能。比如,tRNA(轉運RNA)在轉譯過程中起轉運RNA的作用,rRNA(核糖體RNA)於轉譯過程中起催化肽鏈形成的作用,sRNA(小RNA)起到調控基因表達的作用。此外,RNA病毒甚至以RNA作爲它們的遺傳物質。
RNA通常由DNA經由轉錄生成。RNA在細胞中廣泛分佈,真核生物的細胞核、細胞質、粒線體中都有RNA[2]:36。
目录
1 與DNA的比較
2 結構
3 合成與修飾
4 分類
4.1 调控RNA
4.2 修饰其它RNA
4.3 RNA基因组
4.4 逆转录
4.5 双链RNA
5 发现史
6 参见
7 註釋
8 參考文獻
9 外部链接
與DNA的比較

RNA分子中的含氮鹼基
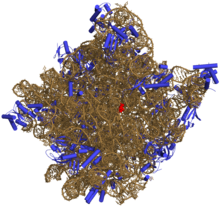
50S核糖體亞單位的3D結構示意圖。rRNA以土黃色表示,蛋白質以藍色表示。活性位點爲rRNA的一個小片段,以紅色標出
與DNA相似,大部分有生物活性的RNA,包括mRNA、tRNA、rRNA、snRNA,以及其他一些非編碼RNA,雖然是單鏈,但含有自我互補的序列,能使得它們能進行摺疊[7],形成互補雙鏈結構(莖)。對RNA的分析表明,它們有着相對更複雜的結構。和DNA不同,RNA的二級結構並不是單純的雙螺旋,而由一系列短的二級結構構成。通過這些短的二級結構的組合,RNA甚至可以擁有與蛋白質相似的結構,並像酶那樣催化化學反應(這樣的RNA被稱爲核酶)[8]。比如,對核糖體進行分析表明,其催化成肽反應的活性位點完全由RNA構成[9]。
| 項目 | DNA | RNA | 解說 |
|---|---|---|---|
| 組成主幹之糖類分子[10] | 2-去氧核糖和磷酸 | 核糖和磷酸 | |
| 骨架結構 | 规则的[11]:50双螺旋结构[12] | 单螺旋结构[12] | 即脱氧核糖核酸由两条脱氧核苷酸链构成,而核糖核酸由一条核糖核苷酸链构成。[11]:49 |
核苷酸數 | 通常上百萬 | 通常數百至數千個 | |
鹼基種類[13][12] | 腺嘌呤(A) --- 胸腺嘧啶(T) 胞嘧啶(C) --- 鳥嘌呤(G) | 腺嘌呤(A) --- 尿嘧啶(U) 胞嘧啶(C) --- 鳥嘌呤(G) | 除部分例外,DNA為胸腺嘧啶,RNA為尿嘧啶,使RNA更易被水解。 |
五碳糖種類[12] | 脫氧核醣 | 核醣 | |
五碳糖連接組成分 | 氫原子 | 羟基 | 在五碳糖的第二個碳原子上連接的組成分不同。 |
| 存在[12] | 细胞核(少量存在于线粒体、叶绿体) | 细胞质 |
結構
siRNA(小干擾RNA)中的鹼基互補配對(圖中省略了氫原子)
RNA的單體爲核糖核苷酸,其中的戊糖爲核糖,依系統命名法可將其中的碳原子從1'編號至5'。含氮鹼基與1'碳原子相連。RNA中最基本的四種鹼基分別爲A(腺嘌呤)、U(尿嘧啶)、G(鳥嘌呤)、C(胞嘧啶)。其中,腺嘌呤和鳥嘌呤爲雙環的嘌呤,尿嘧啶和胞嘧啶爲單環的嘧啶。磷酸基團與一個核糖殘基的3'碳原子相連,與下一個核糖核苷酸的5'碳原子相連。磷酸基團在生理pH下,並不都能帶上負電荷,因而RNA在生理條件下是帶電荷分子(聚陰離子)。C和G、U和A、G和U之間能夠形成氫鍵[14]。不過,鹼基之間也可能發生其他一些相互作用。比如,在一個凸出部分中,一群腺嘌呤可以互相連接[15],GNRA四環中有一個G-A鹼基對[14]。
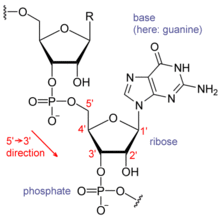
RNA的分子結構
核糖的2位碳上連有羥基爲RNA的一個重要結構特點。這類羥基使得RNA雙鏈的結構應與A型構象最接近[16],不過,在單鏈的某些二核苷酸環境下,也有極小的可能形成DNA最常見的B型螺旋構象[17]。A型構象使得RNA雙鏈的大溝狹窄而深,小溝淺而寬[18]。在RNA分子的構象高度可變區域(即不生成雙鏈結構的區域),2'-OH還能攻擊附近的磷酸二酯鍵,使得核糖-磷酸鏈斷裂[19]。
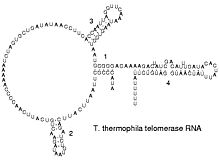
端粒酶RNA的二級結構
通過轉錄,僅僅能使RNA鏈上帶A、U、G、C四種含氮鹼基[20]不過,轉錄後修飾能夠通過多種途徑對RNA進行改造。比如,轉錄後修飾能夠將稀有鹼基假尿嘧啶(Ψ)加到RNA鏈上。假尿嘧啶與核糖之間的化學鍵是C-C鍵而不是尿嘧啶(U)的C-N鍵。胸腺嘧啶加到RNA鏈上的情形也很常見(最典型的例子是tRNA的TΨC環)[21]。另外,次黃嘌呤也是一種常見的稀有鹼基。次黃嘌呤爲腺嘌呤的脫氨產物,含有次黃嘌呤的核苷被稱爲肌苷(I)。在基因編碼的擺動假說中,肌苷有重要的作用[22]。
除以上列出的之外,經過編輯的核苷還有100多種[23]。由修飾引發的結構性變化在tRNA中最爲明顯[24],假尿嘧啶與經常在rRNA中出現2'-甲氧基核糖是最常見的修飾產物[25]。這些修飾的具體作用還沒有完全闡明。不過,值得注意的是,在rRNA中,許多的轉錄後修飾發生在高度功能化的區域,比如肽基轉移酶催化中心以及亞基結合部位,似乎說明轉錄後修飾對RNA發揮正常功能來說相當重要[26]。
具有催化功能的單鏈RNA分子,和蛋白質相類似,需要特殊的RNA三級結構。通過分子內氫鍵形成的二級結構原件構成了三級結構的框架。二級結構形成了許多可識別的「結構域」——比如莖環結構、膨大結構(bulges)、內環結構[27]。因爲RNA分子帶電荷,不少二級結構和三級結構需要Mg2+等金屬離子來進行穩定[28]。
自然界中的RNA均是由D-核糖核苷酸聚合而成的D-RNA。使用L-核糖核苷酸則可合成L-RNA。L-RNA對RNA酶的耐受力要強得多[29]。
合成與修飾
RNA的合成一般由RNA聚合酶催化。RNA聚合酶以DNA爲模板,通過轉錄合成RNA。轉錄起始於RNA聚合酶與啓動子的結合(啓動子一般位於基因的上游)。因爲RNA聚合酶自帶解旋酶活性,僅依靠RNA聚合酶即可實現DNA雙鏈的解開。轉錄過程中,RNA聚合酶以3'端至5'端的方向讀取DNA模板鏈,並以5'端到3'端的方向合成與之反向平行互補的RNA鏈。轉錄的終止由終止子介導。原核生物的終止子有兩類:簡單終止子與ρ因子依賴性終止子。簡單終止子僅靠RNA形成二級結構即可終止轉錄,而後者在ρ因子的作用下才可以使轉錄終止。真核生物的轉錄終止則與轉錄後修飾密切相關[2]:323[30][31]:531-535。
在真核生物中,RNA的初始轉錄物通常會經過轉錄後修飾。比如,真核生物的mRNA大都會被加上Poly(A)尾(多腺嘌呤尾巴)以及5'端帽,mRNA前體中含有的內含子序列也會被剪接體切除[31]:580-581。
一些RNA是由RNA複製酶(RNA依賴性RNA聚合酶)以RNA爲模板催化合成的。比方說,RNA病毒通過RNA複製酶複製其遺傳物質[32]。另外,RNA複製酶亦參與了眾多生物體的RNA干涉過程[33]。
分類
在细胞中,根據結構功能的不同,RNA主要分三類,即tRNA、rRNA,以及mRNA。mRNA是依據DNA序列轉錄而成的蛋白質合成模板;tRNA是mRNA上遺傳密碼的識別者和氨基酸的轉運者;rRNA是組成核糖体的部分,而核糖體是蛋白質合成的機械。
細胞中還有許多種類和功能不一的小型RNA,像是組成剪接體(spliceosome)的snRNA,負責rRNA成型的snoRNA,以及參與RNAi作用的miRNA與siRNA等,可調節基因表現。而其他如I、II型内含子、RNase P、HDV、核糖體RNA等等都有催化生化反應過程的活性,即具有酶的活性,這類RNA被稱為核酶。
调控RNA
許多種類的RNA,能夠透過與mRNA或DNA上的基因片段,部分互補的方式,來調降基因表現。例如在真核生物細胞內,所發現的微RNA(miRNA; 21-22 nt),能引發RNA干擾。miRNA與酵素複合體,會切碎mRNA,阻止該mRNA被轉譯,或加速其降解。[34][35]
雖然小干擾RNA(siRNA; 20-25 nt)的產生,通常是由分解病毒RNA得到,然而也存在內源性的siRNA。[36][37]而siRNA引發RNA干擾的機制類似miRNA,有些miRNA和siRNA,能造成其目標基因被甲基化,從而促進或抑制該基因的轉錄。.[38][39][40]此外,在動物生殖細胞內,所活躍的Piwi-interacting RNA(piRNA; 29-30 nt),被認為能預防轉座子,並在配子的發生上,扮演重要角色。[41][42]
許多的原核生物,具有CRISPR RNAs,其作用機制類似於真核生物的RNA干擾。[43]其中反義RNA(Antisense RNAs)是最常見的,大多數能調降基因表現,但也有少部分會活化轉錄進行。[44]反義RNA的作用機制之一,是藉由與mRNA互補配對,來形成雙股RNA,而被酵素降解。[45]此外,在真核細胞內,也許多能調控基因的非編碼RNA,[46]一個常見的例子是Xist,它會附在雌性哺乳動物的其中一個X染色體上,造成其去活化。[47]
一段mRNA自身可能帶有調控元件,例如riboswitches,在其五端非轉譯區(5' untranslated region)或三端非轉譯區(3' untranslated region),包含有順式作用元件(cis-regulatory elements)能夠調控該mRNA的活性。[48]此外,非編碼區上也有可能帶有,能調控其它基因的調控元件。[49]
修饰其它RNA

一種的常見RNA修飾,尿苷(Uridine)被轉換成假尿苷(Pseudouridine)。
許多的RNA會幫助修飾其它RNA。如前信使RNA(pre-mRNA)中的內含子,會被含有許多核小RNA(snRNA)的剪接體剪接。[6]或者RNA本身能作為核酶,剪接自己的內含子。[50]
RNA上的核苷酸也可能被修飾,變成非A、U、G、C的核苷酸。在真核細胞中,RNA上核苷酸的修飾,通常是由在細胞核與卡哈爾體中發現的,小核仁RNA(snoRNA; 60-300 nt)所主導。[51]snoRNA會連結酵素,並以鹼基對的方式,引導它們去接上RNA,之後酵素便開始RNA核苷酸的修飾。鹼基修飾廣泛發生於rRNA與tRNA中,然而snRNA與mRNA也有可能是鹼基修飾的目標。[52][53]此外,RNA也可能被甲基化。[54][55]
RNA基因组
如同DNA,RNA也可以攜帶遺傳信息。RNA病毒的基因組由RNA組成,可以轉譯出多種蛋白質,其中一些負責基因組的複製,而其它的則作為保護構造,在病毒離開宿主細胞後,保護基因組。類病毒是另一種類型的病原體,但它們僅由RNA組成,且該RNA並不會轉譯出任何蛋白質,並利用宿主的聚合酶來複製。[56]
逆转录
反轉錄病毒藉由將RNA反轉錄成為DNA,DNA副本再轉錄為RNA的方式,來複製他們的基因組。反轉錄轉座子也利用此方法,來複製DNA與RNA,以完成轉座。[57]此外,真核細胞內的端粒酶,也包含一個作為模板的RNA,利用它來延長染色體端粒。[58]
双链RNA
雙鏈RNA(dsRNA)是指具有兩個互補鏈的RNA,與細胞中的DNA結構相似,它也是某些病毒(雙鏈RNA病毒)的遺傳物質。雙鏈RNA如病毒RNA或小干擾RNA(siRNA),可以觸發真核生物的RNA干擾,以及脊椎動物的干擾素反應。[59][60][61][62]
发现史

羅伯特·威廉·霍利(左側)及其研究團隊合影。
與RNA相關的研究,造就了許多生物學的發現,以及諾貝爾獎。而核酸於1868年由弗雷德里希·米歇爾(Friedrich Miescher)發現,當時他將該物質稱作「核素」,因為它是在細胞核中被找到的。[63]但不久後,科學家也在沒有細胞核的原核生物中,也發現了核酸。此外,早在1939年就有人懷疑,RNA在蛋白質合成中所扮演的角色。[64]塞韋羅·奧喬亞(Severo Ochoa de Albornoz)與阿瑟·科恩伯格(Arthur Kornberg),因為在實驗室內發現了,能夠合成RNA的酵素,而獲得1959年的諾貝爾生理學或醫學獎[65]然而,之後的研究顯示,由他們所發現的酵素多核苷酸磷酸化酶,是負責RNA降解,而非RNA合成。
羅伯特·威廉·霍利(Robert W. Holley)於1965年,發現酵母菌裡大小為77個核苷酸的tRNA序列,[66] 並於1968年與哈爾·葛賓·科拉納(Har Gobind Khorana)以及馬歇爾·沃倫·尼倫伯格(Marshall Warren Nirenberg)共同獲得了諾貝爾生理或醫學獎。在1967年,卡爾·烏斯推測RNA可能具有催化能力,並提出建議指出,最早的生命形式(自我複製的分子)可能依賴於RNA,來攜帶遺傳信息和催化生化反應,即RNA世界學說。[67][68]
反轉錄病毒及反轉錄酶,於1970年代早期被發現的,使人們了解到RNA能被反轉錄為DNA(與中心法則的一般情況,DNA轉錄為RNA相反)。 這項發現,使戴維·巴爾的摩(David Baltimore)、羅納托·杜爾貝科(Renato Dulbecco)與霍華德·馬丁·特明(Howard Temin),共同獲得了1975年的諾貝爾生理學或醫學獎。此外在1976年,瓦爾特·菲爾斯以及他的團隊,首度確定了RNA病毒完整基因組的鹼基序列(噬菌體MS2)。[69]
在1997年,菲利普·夏普(Philip Sharp)與理察·羅伯茨(Richard Roberts),因為發現哺乳類動物病毒及細胞基因中,具有內含子且會發生RNA剪接,而獲得1993年的諾貝爾生理學或醫學獎。具有催化功能的RNA(核酶)在1980年代早期被發現,而使得托馬斯·切赫(Thomas Cech)與西德尼·奧爾特曼(Sidney Altman),獲得1989年的諾貝爾化學獎。而1990年所發現在碧冬茄屬上,導入基因會靜默植物體自身相似的基因的現象,現今被認為是RNA干擾的結果。[70][71]
且大約在同時,大小約22個核苷酸的RNA(現在被稱為微RNA),被發現在線蟲的發育上,扮演重要角色。[72]而於RNA干擾的研究,讓安德魯·法厄(Andrew Fire)與克雷格·梅洛(Craig Mello),獲得了2006年的諾貝爾生理學或醫學獎;而同年的諾貝爾化學獎,得獎原因也與RNA相關(在RNA轉錄上的研究),由羅傑·科恩伯格(Roger Kornberg)獲得。此外調控RNA的發現,促使了RNA藥物的開發,如利用小干擾RNA來靜默目標基因。[73]
参见
脱氧核糖核酸(DNA)- 核苷酸
- 核酸
- 核糖核酸生化學
註釋
^ 通過轉錄後修飾,RNA可能會帶上假尿嘧啶(Ψ)這樣的稀有鹼基
參考文獻
^ David Hames & Nigel Hooper. Instant Notes in Biochemistry (導讀本) 3rd edition. 科学出版社. 2005: 193. ISBN 978-7-03-025218-0. 引文格式1维护:冗余文本 (link)
^ 2.02.1 查錫良 藥立波. 生物化學與分子生物學 第八版. 人民衛生出版社. 2013. ISBN 978-7-117-17214-1.
^ RNA: The Versatile Molecule. University of Utah. 2015.
^ Nucleotides and Nucleic Acids (PDF). University of California, Los Angeles.
^ R.N. Shukla. Analysis of Chromosomes. ISBN 9789384568177.
^ 6.06.1 Berg JM, Tymoczko JL, Stryer L. Biochemistry 5th. WH Freeman and Company. 2002: 118–19, 781–808. ISBN 0-7167-4684-0. OCLC 179705944 48055706 59502128.
^ I. Tinoco & C. Bustamante. How RNA folds. J. Mol. Biol. 1999, 293 (2): 271–281. PMID 10550208. doi:10.1006/jmbi.1999.3001.
^ Higgs PG. RNA secondary structure: physical and computational aspects. Quarterly Reviews of Biophysics. 2000, 33 (3): 199–253. PMID 11191843. doi:10.1017/S0033583500003620.
^ Nissen P; Hansen J; Ban N; Moore PB; Steitz TA. The structural basis of ribosome activity in peptide bond synthesis. Science. 2000, 289 (5481): 920–30. Bibcode:2000Sci...289..920N. PMID 10937990. doi:10.1126/science.289.5481.920.
^ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
^ 11.011.1 薛金星. 中学教材全解 工具版 高中生物必修1 分子与细胞. 陕西人民教育出版社. ISBN 9787545015751.
^ 12.012.112.212.312.4 人民教育出版社. 生物1 必修 分子与细胞. ISBN 9787107176708.
^ 生命的螺旋-DNA與RNA. 國立科學工藝博物館.
^ 14.014.1 Lee JC; Gutell RR. Diversity of base-pair conformations and their occurrence in rRNA structure and RNA structural motifs. J. Mol. Biol. 2004, 344 (5): 1225–49. PMID 15561141. doi:10.1016/j.jmb.2004.09.072.
^ Barciszewski J; Frederic B; Clark C. RNA biochemistry and biotechnology. Springer. 1999: 73–87. ISBN 0-7923-5862-7. OCLC 52403776.
^ Salazar M; Fedoroff OY; Miller JM; Ribeiro NS; Reid BR. The DNA strand in DNAoRNA hybrid duplexes is neither B-form nor A-form in solution. Biochemistry. 1992, 32 (16): 4207–15. PMID 7682844. doi:10.1021/bi00067a007.
^ Sedova A; Banavali NK. RNA approaches the B-form in stacked single strand dinucleotide contexts. Biopolymers. 2016, 105 (2): 65–82. PMID 26443416. doi:10.1002/bip.22750.
^ Hermann T; Patel DJ. RNA bulges as architectural and recognition motifs. Structure. 2000, 8 (3): R47–R54. PMID 10745015. doi:10.1016/S0969-2126(00)00110-6.
^ Mikkola S; Stenman E; Nurmi K; Yousefi-Salakdeh E; Strömberg R; Lönnberg H. The mechanism of the metal ion promoted cleavage of RNA phosphodiester bonds involves a general acid catalysis by the metal aquo ion on the departure of the leaving group. Perkin transactions 2. 1999, (8): 1619–26. doi:10.1039/a903691a.
^ Jankowski JAZ; Polak JM. Clinical gene analysis and manipulation: Tools, techniques and troubleshooting. Cambridge University Press. 1996: 14. ISBN 0-521-47896-0. OCLC 33838261.
^ Yu Q; Morrow CD. Identification of critical elements in the tRNA acceptor stem and TΨC loop necessary for human immunodeficiency virus type 1 infectivity. J Virol. 2001, 75 (10): 4902–6. PMC 114245. PMID 11312362. doi:10.1128/JVI.75.10.4902-4906.2001.
^ Elliott MS; Trewyn RW. Inosine biosynthesis in transfer RNA by an enzymatic insertion of hypoxanthine. J. Biol. Chem. 1983, 259 (4): 2407–10. PMID 6365911.
^ Cantara, WA; Crain, PF; Rozenski, J; McCloskey, JA; Harris, KA; Zhang, X; Vendeix, FA; Fabris, D; Agris, PF. The RNA Modification Database, RNAMDB: 2011 update. Nucleic Acids Research. January 2011, 39 (Database issue): D195–201. PMC 3013656. PMID 21071406. doi:10.1093/nar/gkq1028.
^ Söll D; RajBhandary U. TRNA: Structure, biosynthesis, and function. ASM Press. 1995: 165. ISBN 1-55581-073-X. OCLC 183036381.
^ Kiss T. Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs. The EMBO Journal. 2001, 20 (14): 3617–22. PMC 125535. PMID 11447102. doi:10.1093/emboj/20.14.3617.
^ King TH; Liu B; McCully RR; Fournier MJ. Ribosome structure and activity are altered in cells lacking snoRNPs that form pseudouridines in the peptidyl transferase center. Molecular Cell. 2002, 11 (2): 425–35. PMID 12620230. doi:10.1016/S1097-2765(03)00040-6.
^ Mathews DH; Disney MD; Childs JL; Schroeder SJ; Zuker M; Turner DH. Incorporating chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure. Proc. Natl. Acad. Sci. USA. 2004, 101 (19): 7287–92. Bibcode:2004PNAS..101.7287M. PMC 409911. PMID 15123812. doi:10.1073/pnas.0401799101.
^ Tan ZJ; Chen SJ. Salt dependence of nucleic acid hairpin stability. Biophys. J. 2008, 95 (2): 738–52. Bibcode:2008BpJ....95..738T. PMC 2440479. PMID 18424500. doi:10.1529/biophysj.108.131524.
^ Vater A; Klussmann S. Turning mirror-image oligonucleotides into drugs: the evolution of Spiegelmer therapeutics. Drug Discovery Today. January 2015, 20 (1): 147–155. PMID 25236655. doi:10.1016/j.drudis.2014.09.004.
^ Nudler E; Gottesman ME. Transcription termination and anti-termination in E. coli. Genes to Cells. 2002, 7 (8): 755–68. PMID 12167155. doi:10.1046/j.1365-2443.2002.00563.x.
^ 31.031.1 Jocelyn E.KREBS; 等. Gene XI. JONES&BARTLETT LEARNING(高等教育出版社出版). 2014. ISBN 978-7-04-039649-2. 引文格式1维护:显式使用等标签 (link)
^ Jeffrey L Hansen; Alexander M Long; Steve C Schultz. Structure of the RNA-dependent RNA polymerase of poliovirus. Structure. 1997, 5 (8): 1109–22. PMID 9309225. doi:10.1016/S0969-2126(97)00261-X.
^ Ahlquist P. RNA-Dependent RNA Polymerases, Viruses, and RNA Silencing. Science. 2002, 296 (5571): 1270–73. Bibcode:2002Sci...296.1270A. PMID 12016304. doi:10.1126/science.1069132.
^ Wu L, Belasco JG. Let me count the ways: mechanisms of gene regulation by miRNAs and siRNAs. Mol. Cell. January 2008, 29 (1): 1–7. PMID 18206964. doi:10.1016/j.molcel.2007.12.010.
^ Matzke MA, Matzke AJM. Planting the seeds of a new paradigm. PLoS Biology. 2004, 2 (5): e133. PMC 406394. PMID 15138502. doi:10.1371/journal.pbio.0020133.
^ Vazquez F, Vaucheret H, Rajagopalan R, Lepers C, Gasciolli V, Mallory AC, Hilbert J, Bartel DP, Crété P. Endogenous trans-acting siRNAs regulate the accumulation of Arabidopsis mRNAs. Molecular Cell. 2004, 16 (1): 69–79. PMID 15469823. doi:10.1016/j.molcel.2004.09.028.
^ Watanabe T, Totoki Y, Toyoda A; 等. Endogenous siRNAs from naturally formed dsRNAs regulate transcripts in mouse oocytes. Nature. May 2008, 453 (7194): 539–43. Bibcode:2008Natur.453..539W. PMID 18404146. doi:10.1038/nature06908. 引文格式1维护:显式使用等标签 (link)
^ Sontheimer EJ, Carthew RW. Silence from within: endogenous siRNAs and miRNAs. Cell. July 2005, 122 (1): 9–12. PMID 16009127. doi:10.1016/j.cell.2005.06.030.
^ Doran G. RNAi – Is one suffix sufficient?. Journal of RNAi and Gene Silencing. 2007, 3 (1): 217–19. (原始内容存档于2007-07-16).
^ Pushparaj PN, Aarthi JJ, Kumar SD, Manikandan J. RNAi and RNAa — The Yin and Yang of RNAome. Bioinformation. 2008, 2 (6): 235–7. PMC 2258431. PMID 18317570. doi:10.6026/97320630002235.
^ Horwich MD, Li C Matranga C, Vagin V, Farley G, Wang P, Zamore PD. The Drosophila RNA methyltransferase, DmHen1, modifies germline piRNAs and single-stranded siRNAs in RISC. Current Biology. 2007, 17 (14): 1265–72. PMID 17604629. doi:10.1016/j.cub.2007.06.030.
^ Girard A, Sachidanandam R, Hannon GJ, Carmell MA. A germline-specific class of small RNAs binds mammalian Piwi proteins. Nature. 2006, 442 (7099): 199–202. Bibcode:2006Natur.442..199G. PMID 16751776. doi:10.1038/nature04917.
^ Horvath P, Barrangou R. CRISPR/Cas, the Immune System of Bacteria and Archaea. Science. 2010, 327 (5962): 167–70. Bibcode:2010Sci...327..167H. PMID 20056882. doi:10.1126/science.1179555.
^ Wagner EG, Altuvia S, Romby P. Antisense RNAs in bacteria and their genetic elements. Adv Genet. Advances in Genetics. 2002, 46: 361–98. ISBN 9780120176465. PMID 11931231. doi:10.1016/S0065-2660(02)46013-0.
^ Gilbert SF. Developmental Biology 7th. Sinauer. 2003: 101–3. ISBN 0-87893-258-5. OCLC 154656422 154663147 174530692 177000492 177316159 51544170 54743254 59197768 61404850 66754122.
^ Amaral PP, Mattick JS. Noncoding RNA in development. Mammalian genome : official journal of the International Mammalian Genome Society. October 2008, 19 (7–8): 454–92. PMID 18839252. doi:10.1007/s00335-008-9136-7.
^ Heard E, Mongelard F, Arnaud D, Chureau C, Vourc'h C, Avner P. Human XIST yeast artificial chromosome transgenes show partial X inactivation center function in mouse embryonic stem cells. Proc. Natl. Acad. Sci. USA. 1999, 96 (12): 6841–46. Bibcode:1999PNAS...96.6841H. PMC 22003. PMID 10359800. doi:10.1073/pnas.96.12.6841.
^ Batey RT. Structures of regulatory elements in mRNAs. Curr. Opin. Struct. Biol. 2006, 16 (3): 299–306. PMID 16707260. doi:10.1016/j.sbi.2006.05.001.
^ Scotto L, Assoian RK. A GC-rich domain with bifunctional effects on mRNA and protein levels: implications for control of transforming growth factor beta 1 expression. Mol. Cell. Biol. June 1993, 13 (6): 3588–97. PMC 359828. PMID 8497272.
^ Steitz TA, Steitz JA. A general two-metal-ion mechanism for catalytic RNA. Proc. Natl. Acad. Sci. U.S.A. 1993, 90 (14): 6498–502. Bibcode:1993PNAS...90.6498S. PMC 46959. PMID 8341661. doi:10.1073/pnas.90.14.6498.
^ Wirta W. Mining the transcriptome – methods and applications. Stockholm: School of Biotechnology, Royal Institute of Technology. 2006. ISBN 91-7178-436-5. OCLC 185406288.
^ Xie J, Zhang M, Zhou T, Hua X, Tang L, Wu W. Sno/scaRNAbase: a curated database for small nucleolar RNAs and cajal body-specific RNAs. Nucleic Acids Res. 2007, 35 (Database issue): D183–7. PMC 1669756. PMID 17099227. doi:10.1093/nar/gkl873.
^ Omer AD, Ziesche S, Decatur WA, Fournier MJ, Dennis PP. RNA-modifying machines in archaea. Molecular Microbiology. 2003, 48 (3): 617–29. PMID 12694609. doi:10.1046/j.1365-2958.2003.03483.x.
^ Cavaillé J, Nicoloso M, Bachellerie JP. Targeted ribose methylation of RNA in vivo directed by tailored antisense RNA guides. Nature. 1996, 383 (6602): 732–5. Bibcode:1996Natur.383..732C. PMID 8878486. doi:10.1038/383732a0.
^ Kiss-László Z, Henry Y, Bachellerie JP, Caizergues-Ferrer M, Kiss T. Site-specific ribose methylation of preribosomal RNA: a novel function for small nucleolar RNAs. Cell. 1996, 85 (7): 1077–88. PMID 8674114. doi:10.1016/S0092-8674(00)81308-2.
^ Daròs JA, Elena SF, Flores R. Viroids: an Ariadne's thread into the RNA labyrinth. EMBO Rep. 2006, 7 (6): 593–8. PMC 1479586. PMID 16741503. doi:10.1038/sj.embor.7400706.
^ Kalendar R, Vicient CM, Peleg O, Anamthawat-Jonsson K, Bolshoy A, Schulman AH. Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes. Genetics. 2004, 166 (3): 1437–50. PMC 1470764. PMID 15082561. doi:10.1534/genetics.166.3.1437.
^ Podlevsky JD, Bley CJ, Omana RV, Qi X, Chen JJ. The telomerase database. Nucleic Acids Res. 2008, 36 (Database issue): D339–43. PMC 2238860. PMID 18073191. doi:10.1093/nar/gkm700.
^ Blevins T; Rajeswaran, R.; Shivaprasad, P. V.; Beknazariants, D.; Si-Ammour, A.; Park, H.-S.; Vazquez, F.; Robertson, D.; Meins, F.; 等. Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing. Nucleic Acids Res. 2006, 34 (21): 6233–46. PMC 1669714. PMID 17090584. doi:10.1093/nar/gkl886. 引文格式1维护:显式使用等标签 (link)
^ Jana S, Chakraborty C, Nandi S, Deb JK. RNA interference: potential therapeutic targets. Appl. Microbiol. Biotechnol. 2004, 65 (6): 649–57. PMID 15372214. doi:10.1007/s00253-004-1732-1.
^ Schultz U, Kaspers B, Staeheli P. The interferon system of non-mammalian vertebrates. Dev. Comp. Immunol. 2004, 28 (5): 499–508. PMID 15062646. doi:10.1016/j.dci.2003.09.009.
^ PMID 22432611(PubMed)
本引用來源將會在數十分鐘後自動完成。您可以检查英文对应模板或手動擴充
^ Dahm R. Friedrich Miescher and the discovery of DNA. Developmental Biology. 2005, 278 (2): 274–88. PMID 15680349. doi:10.1016/j.ydbio.2004.11.028.
^ Caspersson T, Schultz J. Pentose nucleotides in the cytoplasm of growing tissues. Nature. 1939, 143 (3623): 602–3. Bibcode:1939Natur.143..602C. doi:10.1038/143602c0.
^ Ochoa S. Enzymatic synthesis of ribonucleic acid (PDF). Nobel Lecture. 1959.
^ Holley RW; Apgar, J.; Everett, G. A.; Madison, J. T.; Marquisee, M.; Merrill, S. H.; Penswick, J. R.; Zamir, A.; 等. Structure of a ribonucleic acid. Science. 1965, 147 (3664): 1462–65. Bibcode:1965Sci...147.1462H. PMID 14263761. doi:10.1126/science.147.3664.1462. 引文格式1维护:显式使用等标签 (link)
^ Siebert S. Common sequence structure properties and stable regions in RNA secondary structures (PDF). Dissertation, Albert-Ludwigs-Universität, Freiburg im Breisgau: 1. 2006. (原始内容 (PDF)存档于2012-03-09).
^ Szathmáry E. The origin of the genetic code: amino acids as cofactors in an RNA world. Trends Genet. 1999, 15 (6): 223–9. PMID 10354582. doi:10.1016/S0168-9525(99)01730-8.
^ Fiers W; Ysebaert, R.; Duerinck, F.; Haegeman, G.; Iserentant, D.; Merregaert, J.; Min Jou, W.; Molemans, F.; Raeymaekers, A.; 等. Complete nucleotide-sequence of bacteriophage MS2-RNA: primary and secondary structure of replicase gene. Nature. 1976, 260 (5551): 500–7. Bibcode:1976Natur.260..500F. PMID 1264203. doi:10.1038/260500a0. 引文格式1维护:显式使用等标签 (link)
^ Napoli C, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans. Plant Cell. 1990, 2 (4): 279–89. PMC 159885. PMID 12354959. doi:10.1105/tpc.2.4.279.
^ Dafny-Yelin M, Chung SM, Frankman EL, Tzfira T. pSAT RNA interference vectors: a modular series for multiple gene down-regulation in plants. Plant Physiol. December 2007, 145 (4): 1272–81. PMC 2151715. PMID 17766396. doi:10.1104/pp.107.106062.
^ Ruvkun G. Glimpses of a tiny RNA world. Science. 2001, 294 (5543): 797–99. PMID 11679654. doi:10.1126/science.1066315.
^ Fichou Y, Férec C. The potential of oligonucleotides for therapeutic applications. Trends in Biotechnology. 2006, 24 (12): 563–70. PMID 17045686. doi:10.1016/j.tibtech.2006.10.003.
外部链接
(英文)RNA World website链接大全(结构,测序,工具和期刊)
(英文)核酸数据库内有DNA, RNA和相关化合物的图片。
| ||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|