苯胺
 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP
| 苯胺 | |||
|---|---|---|---|
| |||
| 别名 | 氨基苯、阿尼林油 | ||
| 识别 | |||
CAS号 | 62-53-3 142-04-1((HCl)) | ||
PubChem | 6115 8870((HCl)) | ||
ChemSpider | 5889 | ||
SMILES |
| ||
InChI |
| ||
InChIKey | PAYRUJLWNCNPSJ-UHFFFAOYAP | ||
ChEBI | 17296 | ||
DrugBank | DB06728 | ||
KEGG | C00292 | ||
| 性质 | |||
化学式 | C6H7N | ||
摩尔质量 | 93.126 g·mol⁻¹ | ||
| 外观 | 无色液体 | ||
密度 | 1.0217 g/ml(液) | ||
熔点 | −6.3 °C | ||
沸点 | 184.13 °C | ||
溶解性(水) | 3.6 g/100 mL,20 °C | ||
pKa | 27(共轭酸的pKa = 4.87) | ||
pKb | 9.40 | ||
黏度 | 3.71 cP(25 °C) | ||
| 热力学 | |||
ΔcHm | -3394 kJ/mol | ||
| 危险性 | |||
欧盟危险性符号  有毒 T 有毒 T 危害环境N 危害环境N | |||
警示术语 | R:R23/24/25-R40-R41-R43-R48/23/24/25-R68-R50 | ||
安全术语 | S:S1/2-S26-S27-S36/37/39-S45-S46-S61-S63 | ||
NFPA 704 |  2 3 0 | ||
| 相关物质 | |||
| 相关芳香胺 | 1-萘胺、2-萘胺 | ||
| 相关化学品 | 苯肼、亚硝基苯、硝基苯 | ||
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |||
苯胺(英语:Aniline)又称阿尼林油、胺基苯,分子式:C6H7N,分子量:93.128,CAS编号:62-53-3。苯胺是最重要的芳香族胺之一,腐魚味,燃燒的火焰會生煙。
苯胺是最重要的胺類物質之一。主要用于制造染料、药物、树脂,还可以用作橡胶硫化促进剂等。它本身也可作为黑色染料使用。其衍生物甲基橙可作為酸鹼滴定用的指示劑。
目录
1 製備
2 物理性质
3 化学性质
3.1 鹼性
3.2 活泼性
3.3 生成重氮盐
4 结构特性
5 生化特性
6 参见
7 参考文献
製備
工业上制取苯胺涉及以下两步。首先,苯在 50~60 °C 在浓硫酸和浓硝酸的混合物硝化,得到硝基苯;后者再被催化加氢还原(反应温度通常在 200~300 °C 之间)。
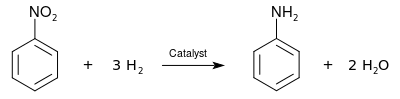 [1]
[1]苯胺亦可由氨气和苯酚制得,后者常使用异丙苯法制得。[2]
商业上,有三档纯度不同的苯胺通过标牌区分:蓝色标牌的阿尼林油(高纯苯胺);红色标牌的阿尼林油(混有一定量的甲基苯胺);以及制取番红用的苯胺,通常是从品红中蒸馏出的。[來源請求]
物理性质
- 外观与性状:无色或微黄色油状液体,有强烈气味。
- 熔点(℃):-6.2
- 相对密度(水=1):1.02
- 沸点(℃):184.4
- 相对蒸气密度(空气=1):3.22
- 分子式:C6H7N
- 分子量:93.128
- 粘度,CP 3.71(25℃)
- CAS号62-53-3
- 饱和蒸气压(kPa):2.00(77℃)
- 燃烧热(kJ/mol):3389.8
- 临界温度(℃):425.6
- 临界压力(MPa):5.30
- 辛醇/水分配系数的对数值:0.94
- 折光率1.5863
- 闪点(℃):70
- 爆炸上限%(V/V):11.0
- 爆炸下限%(V/V):1.3
- 溶解性:微溶于水,溶于乙醇、乙醚、苯。
化学性质
弱碱性,由於苯環穩定了氮上的孤對電子,使其鹼性較脂肪族胺類低了許多。苯胺能与盐酸化合生成盐酸盐,与硫酸化合成硫酸盐。能起卤化、乙酰化、重氮化等作用。遇明火、可燃。
鹼性
苯胺的氨基與電負度較高的sp2碳連接,且氮上電子雲會共振到苯環上的pi系統(非定域化),使的苯胺的鹼性較低。苯胺會與強酸反應形成苯銨陽離子(C6H5-NH3+),也會與鋅、鋁、鐵(III)離子形成鹽類沉澱,加熱其鹽類會釋放氨氣。
活泼性
氨基是活化基团,它能使苯环活化。苯胺更容易进行亲电取代反应,如和溴水作用,立刻形成2,4,6-三溴苯胺。如果要得到一溴产物,则需要用乙酸酐对氨基保护,形成乙酰苯胺,然后再和溴反应,水解之后得到对溴苯胺。[3]
生成重氮盐
苯胺与亚硝酸在0~5℃反应,可以得到重氮盐。
结构特性
苯胺中的氮sp3杂化孤对电子占据的轨道可与苯环共轭,电子可分散于苯环上,使氮周围的电子云密度减小。
生化特性
- 健康危害:该品主要引起高铁血红蛋白血症、溶血性贫血和肝、肾损害。易经皮肤吸收。急性中毒:患者口唇、指端、耳廓紫绀,有头痛、头晕、恶心、呕吐、手指发麻、精神恍惚等;重度中毒时,皮肤、粘膜严重青紫,呼吸困难,抽搐,甚至昏迷,休克。出现溶血性黄疸、中毒性肝炎及肾损害。可有化学性膀胱炎。眼接触引起结膜角膜炎。慢性中毒:患者有神经衰弱综合征表现,伴有轻度紫绀、贫血和肝、脾肿大。皮肤接触可引起湿疹。
- 环境危害:对环境有危害,对水体可造成污染。
- 燃爆危险:该品可燃,有毒。
- 毒理:苯胺经呼吸道、消化道、皮肤进入人体。生产中经皮肤吸入为主要途径。温度、湿度增加,吸收增加。入血后经氧化作用形成对氨基酚由尿排出。尿中对氨基酚量与高铁血红蛋白量平行关系。呼吸道吸入的少量苯胺以原形有呼吸道排出。苯胺的毒性主要与其代谢产物苯基羟胺有关,苯基羟胺很强的高铁血红蛋白形成能力,使血红蛋白失去携氧能力,机体缺氧、溶血,引起中枢神经系统、心血管系统和其他脏器损伤。
参见
- 胺
- 官能团
参考文献
^ Caskey, Douglas C.; Chapman, Douglas W., Process for the preparation of arylhydroxylamines, Apr 24, 1985 [2016-06-16]
^ Thomas Kahl, Kai-Wilfrid Schröder, F. R. Lawrence, W. J. Marshall, Hartmut Höke, Rudolf Jäckh "Aniline" in Ullmann's Encyclopedia of Industrial Chemistry 2007; John Wiley & Sons: New York.doi:10.1002/14356007.a02_303
^ 天津大学有机化学教研室. 《有机化学》第五版. 高等教育出版社, 2014. pp 491-492. ISBN 978-7-04-039598-3
|

