鿫
 Clash Royale CLAN TAG#URR8PPP
Clash Royale CLAN TAG#URR8PPP
| 本条目翻譯品質不佳。 |
body.skin-minerva .mw-parser-output table.infobox captiontext-align:center
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 名稱·符號·序數 | 鿫(Oganesson)·Og·118 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 未知 可能為稀有氣體 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 18 ·7·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | [294] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [Rn] 5f14 6d10 7s2 7p6 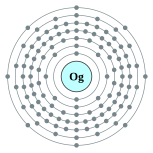 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 聯合核研究所及勞倫斯利福摩爾國家實驗室(2002年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固體(預測,目前計算表明,它不太可能是氣體)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (預測)13.65[3]g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | (推算)350±30[1]K,80±30 °C,170±50 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 臨界點 | (推算)439[4] K,6.8[4] MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | (推算)23.5[4]kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | (推算)19.4[4] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | (預測)−1,[2] 0, +1,[5]+2[6], +4[6], +6[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:(推算)839.4[2]kJ·mol−1 第二:(推算)1450[7] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | (預測)152[3]pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | (預測)157[8] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 54144-19-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:鿫的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
鿫[10][11][12](Oganesson,Og)是一種人工合成的超重元素,原子序為118。其最早於2002年被位於俄羅斯杜布納聯合核研究所(JINR)的科學家成功合成,並在2015年12月由國際純化學和應用化學聯合會(IUPAC)及國際純粹與應用物理學聯合會(IUPAP)所組成的聯合工作小組所確認。在元素週期表上,它位於p區,屬於18族,是第7週期中的最後一個元素。其原子序数和原子量為所有已發現元素中最高的。
Og具放射性,其原子十分不穩定。截至2012年,探測到的294Og同位素的原子一共只有4個。[13]這使對Og特性和可能的化合物的實驗研究相當困難。目前理論計算作出了一些有關其特性的預測,其中一些是出乎意料的。例如,Og是18族成員,但它有可能並不是惰性氣體。[1]之前它曾被認為是一氣體,但現在的預測卻表示,由於相对论量子化学性因素,它在標準狀況下會是固體。[1]
目录
1 歷史
1.1 未成功的嘗試
1.2 發現
2 命名
3 特性
3.1 原子核穩定性與同位素
3.2 計算的原子及物理特性
3.3 預測的化合物
4 參見
5 参考文献
6 外部連結
歷史
未成功的嘗試
1998年末,波蘭物理學家Robert Smolańczuk發表了一套計算法,以解釋如何通過融合原子核來合成超重元素的原子,當中也包括了Og。[14]他的計算表示,在嚴格控制的環境下融合鉛和氪,就能製成Og。[14]
1999年,勞倫斯伯克利國家實驗室的研究人員利用這些計算,製造了鉝和Og,並將發現發佈於《物理評論快報》。[15]不久之後《科學》雜誌也報導了這一發現。[16]研究人員聲稱成功進行了以下核反应:
- Kr3686+Pb82208⟶Og118293+n01displaystyle ce ^86_36Kr+ ^208_82Pb -> ^293_118Og+ ^1_0n
2000年,因為其他的實驗室及勞倫斯伯克利國家實驗室本身都未能重複這些結果,所以研究人員撤回了該發現。[17]2002年6月,實驗室主任宣布原先兩個元素的發現結果所用的數據是由维克托・尼诺夫編造的。[18]
發現
2002年,位於俄羅斯杜布納由尤里·奥加涅相帶領的團隊於聯合核研究所(JINR)首次發現並觀測Og原子的衰變。[19]2006年10月9日,來自聯合核研究所及美國加州勞倫斯利福摩爾國家實驗室的研究人員宣布[9]他們間接探測到一共3個(可能4個)294Og的原子(其中1或2個發現於2002年,[20]其餘2個於2005年)。方法是通過撞擊鉲249和鈣48離子:[21][22][23][24][25]
- 98249Cf+2048Ca→118294Og+301ndisplaystyle ,_98^249mathrm Cf +,_20^48mathrm Ca to ,_118^294mathrm Og +3,_0^1mathrm n

Og-294同位素的放射性衰變示意圖。[9]列出同位素的衰變能量和平均半衰期。進行自發裂變的原子以綠色表示。
由於核聚變概率(聚變截面約為0.3~0.6 pb = (3~6)×10−41 m2)很低,實驗經過了48個月,使用了4×1019個鈣離子,才第一次測得Og的合成。[26]探測結果是隨機事件的可能性估計小於100,000分之1,所以研究人員很有把握這並不是誤測。[27]
實驗觀察到的有3個Og原子的α衰變,而研究人員也提出了第4個通過直接自發裂變的衰變。294Og通過α衰變產生290Lv。由於只觀測到3個原子的衰變,因此計算出來的半衰期有著很大的誤差:0.89+1.07
−0.31 ms。[9]
- 118294Og→116290Lv+24Hedisplaystyle ,_118^294mathrm Og to ,_116^290mathrm Lv +,_2^4mathrm He
為了確定產生了294Og,科學家再通過撞擊245Cm和48Ca離子,產生了290Lv原子核:
- 96245Cm+2048Ca→116290Lv+301ndisplaystyle ,_96^245mathrm Cm +,_20^48mathrm Ca to ,_116^290mathrm Lv +3,_0^1mathrm n
並比較290Lv與294Og原子核的衰變鏈是否相同。[9]290Lv原子核十分不穩定,半衰期只有14毫秒,便衰變為286Fl,再經由自發裂變或α衰變成為282Cn,然後進行自發裂變。[28]
根據量子穿隧模型,294Og的α衰變半衰期預測為0.66+0.23
−0.18 ms[29],理論核反應能量(Q值)於2004年發表。[30]如果在計算中使用Muntian–Hofman–Patyk–Sobiczewski宏觀微觀模型得出的Q值,則結果會相對較低,但仍很接近。[31]
在成功取得Og之後,科學家希望通過融合58Fe和244Pu來製造120號元素Ubn。[32]Ubn同位素的半衰期預計只有數微秒。[33][34]
| 目標 | 發射體 | CN | 結果 |
|---|---|---|---|
208Pb | 86Kr | 294Og | 至今失敗 |
249Cf | 48Ca | 297Og | 反應成功 |
命名

Oganesson的中文命名
直至1960年代Og仍被稱為eka-emanation(emanation是氡的舊稱)。[35]1979年IUPAC發表了對元素新命名的建議,並將其命名為ununoctium。[36]該系統命名在證實發現該元素且IUPAC授予名稱之前,作為118號元素的代替名。
2002年發現結果被撤回之前,勞倫斯伯克利國家實驗室的研究人員曾建議以阿伯特·吉奧索(Albert Ghiorso,研究團隊的領導成員)命名為ghiorsium(Gh)。[37]
俄羅斯的發現者於2006年公佈發現此元素。2007年,聯合核研究所主任表示,研究團隊正考慮兩個名字:以格奥尔基·弗廖罗夫(Georgy Flyorov,杜布納的研究實驗室創立人)命名为Flyorium(现成为114号元素𫓧的名称,Flerovium),及以莫斯科州(Moscow Oblast,杜布納所在地)命名的Moskovium(现成为115元素镆的名称,Moscovium)。[38]他也表示,雖然這是俄美合作發現的(美國提供撞擊中的目標元素鉲),但Uuo名正言順地應以俄羅斯命名,因為聯合核研究所的Flerov核反應實驗室是世界上唯一一座能取得這種成果的設施。[39][40]IUPAC於2016年6月8日建議將此元素命名為Oganesson(Og),以表揚奧加涅相的貢獻,此名稱於2016年11月28日正式獲得認可。[41]
2017年1月15日,中華人民共和國全国科学技术名词审定委员会联合国家语言文字工作委员会组织化学、物理学、语言学界专家召开了113号、115号、117号、118号元素中文定名会,將此元素命名為「鿫」。[10][12]
2017年4月5日,中華民國國家教育研究院的化學名詞審譯委員會審譯修正通過之「化學元素一覽表」將此元素命名為「鿫」,音同「澳」。[11],2018年6月5日,「鿫」字被正式加入統一碼11.0版本中,碼位為U+9FEB。
特性
原子核穩定性與同位素

理論推測的穩定島的三維示意圖。Og位於穩定島的右端,其原子核應比預測的更穩定一些。
原子序超過82(鉛)的元素均沒有穩定的同位素。[42]原子核的穩定性隨原子序的增加而降低,因此所有原子序超過105(※此字在您的系统上可能无法显示,因而变成空白、方块或问号。">𬭊)的同位素半衰期都小於1天。然而由於一些尚待瞭解的原因(見魔數),原子序110至114的穩定性有著稍微的提升,這就是核物理所預測的“穩定島”。這個概念由伯克利加州大學教授格倫·西奧多·西博格提出,以解釋超重元素半衰期比本來預計要長的原因。[43]Og是有放射性的,其半衰期少於1毫秒。不過,這數值已經比某些預計值較長,[29][44]這進一步支持“穩定島”這一理論。[45]
量子穿隧模型計算預測,Og還有幾個α衰變半衰期接近1毫秒的多中子同位素。[33][34]
理論計算顯示,一些Og同位素比已發現的294Og更加穩定,最有可能的包括:293Og、295Og、296Og、297Og、298Og、300Og和302Og。[29][46]其中297Og最有機會擁有長半衰期,[29][46]所以可能會是未來的重點工作對象。一些313Og附近的多中子原子核也可能有較長的半衰期。[47]
計算的原子及物理特性
Og屬於18族,沒有價電子。這一族的元素的價電子層符合八隅體規則,因此幾乎對所有普通化學(如氧化作用)反應顯惰性。這樣形成的電子排布是緊密和穩定的,並擁有最低能量。[48]科學家相信Og也同樣有填滿了的價電子層,其電子排布為:7s27p6。[1]
一些人預計Og的物理及化學特性會與同族的其他元素相似,最接近其上的惰性氣體氡。[49]根據週期表的趨勢,Og估計比氡更活躍一些。然而,理論計算卻顯示,它可能會非常活躍,並不一定能被稱為惰性氣體。[50]Og甚至可能比鈇和鎶還活躍。[51]Og的化學活性比氡明顯較高,要歸咎於其7p電子支殼層的徑向膨脹及能量的不穩定性。[1][52]更準確地說,7p電子與7s2電子間有著很大的自旋-軌道作用,導致第二個價電子層在鈇處填滿,使Og的穩定性大大降低。[1]計算也指出,Og和其他惰性氣體不同:它接受電子時會釋放能量,也就是它有正的電子親和力。[53][54][55]
Og的極化性是之前所有元素中最高的,幾乎是氡的兩倍。[1]從其他惰性氣體的沸點趨勢估計,Og的沸點處於320 K和380 K之間。[1]這和先前的估值263 K[56]和247 K要高。[57]甚至在加上巨大的計算誤差後,Og在標準狀況下仍不會呈氣態。[1][58]由於其他惰性氣體的液態溫度區間很小,介乎2 K至9 K間,所以Og應該是一種固體。如果它是氣體的話,將會是標準狀態下密度最高的氣體(儘管它和其餘的惰性氣體一樣是單原子的)。
由於極化性極高,Og的電離能異常低(類似於鉛,是氡的70%[5],明顯低於鈇[59]),並擁有標準凝聚態。[1]
預測的化合物

XeF4與RnF4擁有平面四方形的結構。

OgF4預計擁有四面體結構。
科學家自1964年起便開始進行了有關Og的理論化合物的計算,但至今還沒有合成任何Og化合物。[35]如果一個元素的電離能足夠高的話,它會非常難氧化,因此最可能的氧化態是0(正如其餘的惰性氣體)。[60]
對二聚體Og2的計算指出,化學鍵間的交互作用和Hg2的相約,鍵離解能為6 kJ/mol,約為Rn2的四倍。[1]但最出乎意料的是,其鍵長比Rn2的還短0.16 Å。[1]另外,化合物OgH+的鍵離解能(或Og的質子親和能)比RnH+小。[1]
OgH中Og和氫之間的鍵可看作是純粹的范德華力,而不是真正的化學鍵。[5]另外,Og與一些電負性高的元素能組成穩定的化合物,甚至超過鎶或鈇。[5]氟化物OgF2和OgF4中,Og預測有穩定的+2和+4氧化態。[61]這也是由於Og的自旋-軌道作用。例如,計算顯示,Og和F2產生OgF2的化學反應會釋出106 kcal/mol的能量,其中約46 kcal/mol來自於這些相互作用。[5]對比之下,類似的分子RnF2的產生能量為49 kcal/mol,交互作用佔約10 kcal/mol。[5]同樣的相互作用使OgF4的四面體形Td結構比較穩定,有別於XeF4和RnF4的D4h对称性結構。[61]當中的Og–F鍵最可能是離子鍵,而非共價鍵,因此OgFn化合物都不具有揮發性。[6][62]Og的電正性足以與氯產生Og–Cl鍵,這於其他的惰性氣體非常不同。[6]
由於產量極其稀少(一共只製造了4個Og原子),所以目前Og在基本科學研究範疇以外沒有任何用途。當足夠的Og集聚在一處,其釋放的核辐射可造成傷害。[63]
參見
- 錒系後元素
- 超鈾元素
- 鉝
参考文献
^ 1.001.011.021.031.041.051.061.071.081.091.101.111.121.131.14 Nash, Clinton S. Atomic and Molecular Properties of Elements 112, 114, and 118. Journal of Physical Chemistry A. 2005, 109 (15): 3493–3500. PMID 16833687. doi:10.1021/jp050736o. 使用|accessdate=需要含有|url=(帮助)
^ 2.02.12.22.3 Haire, Richard G. Transactinides and the future elements. (编) Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006: 1724. ISBN 1-4020-3555-1.
^ 3.03.1 Moskowium. Apsidium. [2008-01-18]. (原始内容存档于2008-01-17).
^ 4.04.14.24.3 Eichler, R.; Eichler, B., Thermochemical Properties of the Elements Rn, 112, 114, and 118 (PDF), Paul Scherrer Institut, [2010-10-23], (原始内容 (PDF)存档于2011-07-07)
^ 5.05.15.25.35.45.5 Han, Young-Kyu; Bae, Cheolbeom; Son, Sang-Kil; Lee, Yoon Sup. Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118). Journal of Chemical Physics. 2000, 112 (6): 2684. Bibcode:2000JChPh.112.2684H. doi:10.1063/1.480842.
^ 6.06.16.26.3 Kaldor, Uzi; Wilson, Stephen. Theoretical Chemistry and Physics of Heavy and Superheavy Elements. Springer. 2003: 105 [2008-01-18]. ISBN 140201371X.
^ Seaborg, Glenn Theodore. Modern Alchemy. World Scientific. 1994: 172 [2008-01-18]. ISBN 9810214405.
^ Chemical Data. Ununoctium - Uuo, Royal Chemical Society
^ 9.09.19.29.39.4 Oganessian, Yu. Ts.; Utyonkov, V.K.; Lobanov, Yu.V.; Abdullin, F.Sh.; Polyakov, A.N.; Sagaidak, R.N.; Shirokovsky, I.V.; Tsyganov, Yu.S.; Voinov, Yu.S.; Gulbekian, G.G.; Bogomolov, S.L.; B. N. Gikal, A. N. Mezentsev, S. Iliev; Subbotin, V.G.; Sukhov, A.M.; Subotic, K; Zagrebaev, V.I.; Vostokin, G.K.; Itkis, M. G.; Moody, K.J; Patin, J.B.; Shaughnessy, D.A.; Stoyer, M.A.; Stoyer, N.J.; Wilk, P.A.; Kenneally, J.M.; Landrum, J.H.; Wild, J.H.; Lougheed, R.W. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions. Physical Review C. 2006-10-09, 74 (4): 044602 [2008-01-18]. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602.
^ 10.010.1 全国科技名词委联合国家语言文字工作委员会召开113号、115号、117号、118号元素中文定名会. [2017-02-16] (中文(中国大陆)). ,半包围结构,形如“奥气”,内奥外气,Unicode9.0暂无此字,使用表意文字描述符表达。
^ 11.011.1 本院化學名詞審譯委員會審譯修正通過之「化學元素一覽表」,歡迎使用並提供寶貴建議。. 國家教育研究院. 2017-04-05 [2017-04-17] (中文(台灣)).
^ 12.012.1 丁佳. 中科院等公布4个新元素中文名. 科学网. 2017-05-09 [2018-06-28] (中文(中国大陆)).
^ The Top 6 Physics Stories of 2006. Discover Magazine. 2007-01-07 [2008-01-18].
^ 14.014.1 Smolanczuk, R. Production mechanism of superheavy nuclei in cold fusion reactions. Physical Review C. 1999, 59 (5): 2634–2639. doi:10.1103/PhysRevC.59.2634.
^ Ninov, Viktor; 等. Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb. Physical Review Letters. 1999, 83: 1104–1107. doi:10.1103/PhysRevLett.83.1104.
^ Service, R. F. Berkeley Crew Bags Element 118. Science. 1999, 284: 1751. doi:10.1126/science.284.5421.1751.
^ Public Affairs Department. Results of element 118 experiment retracted. Berkeley Lab. 2001-07-21 [2008-01-18]. (原始内容存档于2008-01-29).
^ Dalton, Rex. Misconduct: The stars who fell to Earth. Nature. 2002, 420 (6917): 728–729. PMID 12490902. doi:10.1038/420728a.
^ Oganessian, Yu. T.; 等. Results from the first 249Cf+48Ca experiment (PDF). JINR Communication (JINR, Dubna). 2002. (原始内容 (PDF)存档于2004-12-13) (俄语).
^ Oganessian, Yu. T.; 等. Element 118: results from the first 249Cf + 48Ca experiment. Communication of the Joint Institute for Nuclear Research JINR Publishing Department. 2002 [2008-01-18]. (原始内容存档于2011-07-22).
^ Livermore scientists team with Russia to discover element 118. Livermore press release. 2006-12-03 [2008-01-18]. (原始内容存档于2010-05-27).
^ Oganessian, Yu. T. Synthesis and decay properties of superheavy elements. Pure Appl. Chem. 2006, 78: 889–904. doi:10.1351/pac200678050889.
^ Sanderson, K. Heaviest element made – again. Nature News (Nature). 2006. doi:10.1038/news061016-4.
^ Schewe, P. and Stein, B. Elements 116 and 118 Are Discovered. Physics News Update. American Institute of Physics. 2006-10-17 [2008-01-18]. (原始内容存档于2012-01-01).
^ Weiss, R. Scientists Announce Creation of Atomic Element, the Heaviest Yet. Washington Post. 2006-10-17 [2008-01-18].
^ Ununoctium. WebElements Periodic Table. [2008-01-18].
^ Element 118 Detected, With Confidence. Chemical and Engineering news. 2006-10-17 [2008-01-18]. (原始内容存档于2006-11-04).I would say we're very confident.
^ Oganessian, Yu. T.; 等. Synthesis of the isotopes of elements 118 and 116 in the 249Cn and 245Cm + 48Ca fusion reactions. Physical Review C. 2006, 74 (4): 044602. doi:10.1103/PhysRevC.74.044602.
^ 29.029.129.229.3 Chowdhury, Roy P.; Samanta, C.; Basu, D. N. α decay half-lives of new superheavy elements. Phys. Rev. C. 2006, 73: 014612. doi:10.1103/PhysRevC.73.014612.
^ Oganessian; Yu. T.; 等. Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactions 233, 238U, 242Pu, and 248Cm+48Ca. Phys. Rev. C. 2004, 70: 064609. doi:10.1103/PhysRevC.70.064609.
^ Samanta, C.; Chowdhury, R. P.; Basu, D.N. Predictions of alpha decay half lives of heavy and superheavy elements. Nucl. Phys. A. 2007, 789: 142–154. doi:10.1016/j.nuclphysa.2007.04.001.
^ A New Block on the Periodic Table (PDF). Lawrence Livermore National Laboratory. April 2007 [2008-01-18].
^ 33.033.1 Chowdhury, Roy P.; Samanta, C.; Basu, D. N. Search for long lived heaviest nuclei beyond the valley of stability. Physical Reviews C. 2008, 77: 044603. doi:10.1103/PhysRevC.77.044603.
^ 34.034.1 Chowdhury, R. P.; Samanta, C.; Basu, D.N. Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130. At. Data & Nucl. Data Tables. 2008, 94: 781–806. doi:10.1016/j.adt.2008.01.003.
^ 35.035.1 Grosse, A. V. Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em). Journal of Inorganic and Nuclear Chemistry (Elsevier Science Ltd.). 1965, 27 (3): 509–19. doi:10.1016/0022-1902(65)80255-X.
^ Chatt, J. Recommendations for the Naming of Elements of Atomic Numbers Greater than 100. Pure Appl. Chem. 1979, 51: 381–384. doi:10.1351/pac197951020381.
^ Discovery of New Elements Makes Front Page News. Berkeley Lab Research Review Summer 1999. 1999 [2008-01-18].
^ New chemical elements discovered in Russia`s Science City. 2007-02-12 [2008-02-09].
^ NewsInfo. Periodic table has expanded. Rambler. 2006-10-17 [2008-01-18]. (原始内容存档于2012-02-05) (俄语).
^ Yemel'yanova, Asya. 118th element will be named in Russian. vesti.ru. 2006-12-17 [2008-01-18] (俄语).
^ Elements 113, 115, 117, and 118 are now formally named nihonium (Nh), moscovium (Mc), tennessine (Ts), and oganesson (Og). IUPAC. 2016-11-30 [2016-11-30].
^ Marcillac, Pierre de; Noël Coron; Gérard Dambier; Jacques Leblanc; Jean-Pierre Moalic. Experimental detection of α-particles from the radioactive decay of natural bismuth. Nature. April 2003, 422 (6934): 876–878. PMID 12712201. doi:10.1038/nature01541.
^ Considine, Glenn D.; Kulik, Peter H. Van Nostrand's scientific encyclopedia 9. Wiley-Interscience. 2002. ISBN 9780471332305. OCLC 223349096.
^ Oganessian, Yu. T. Heaviest nuclei from 48Ca-induced reactions. Journal of Physics G: Nuclear and Particle Physics. 2007, 34: R165–R242. doi:10.1088/0954-3899/34/4/R01.
^ New Element Isolated Only Briefly. The Daily Californian. 2006-10-18 [2008-01-18]. (原始内容存档于2008-10-08).
^ 46.046.1 Royer, G.; Zbiri, K.; Bonilla, C. Entrance channels and alpha decay half-lives of the heaviest elements. Nuclear Physics A. 2004, 730: 355–376. doi:10.1016/j.nuclphysa.2003.11.010.
^ Duarte, S. B.; Tavares, O. A. P.; Gonçalves, M.; Rodríguez, O.; Guzmán, F.; Barbosa, T. N.; García, F.; Dimarco, A. Half-life predictions for decay modes of superheavy nuclei. Journal of Physics G: Nuclear and Particle Physics. 2004, 30: 1487–1494. doi:10.1088/0954-3899/30/10/014.
^ Bader, Richard F.W. An Introduction to the Electronic Structure of Atoms and Molecules. McMaster University. [2008-01-18].
^ Ununoctium (Og) – Chemical properties, Health and Environmental effects. Lenntech. [2008-01-18]. (原始内容存档于一月 16, 2008). 请检查|archive-date=中的日期值 (帮助)
^ Kaldor, Uzi; Wilson, Stephen. Theoretical Chemistry and Physics of Heavy and Superheavy Elements. Springer. 2003: 105. ISBN 140201371X.
^ Nash, Clinton S. Atomic and Molecular Properties of Elements 112, 114, and 118. Journal of Physical Chemistry A. 2005, 109 (15): 3493–3500. PMID 16833687. doi:10.1021/jp050736o.
^ 原文:"The reason for the apparent enhancement of chemical activity of element 118 relative to radon is the energetic destabilization and radial expansion of its occupied 7p3/2spinor shell"
^ Goidenko, Igor; Labzowsky, Leonti; Eliav, Ephraim; Kaldor, Uzi; Pyykko¨, Pekka. QED corrections to the binding energy of the eka-radon (Z=118) negative ion. Physical Review A. 2003, 67: 020102(R). doi:10.1103/PhysRevA.67.020102.
^ Eliav, Ephraim; Kaldor, Uzi; Ishikawa, Y; Pyykkö, P. Element 118: The First Rare Gas with an Electron Affinity. Physical Review Letters. 1996, 77 (27): 5350. PMID 10062781. doi:10.1103/PhysRevLett.77.5350.
^ Nevertheless, quantum electrodynamic corrections have been shown to be quite significant in reducing this affinity (by decreasing the binding in the anion Og− by 9%) thus confirming the importance of these corrections in superheavy atoms. See Pyykko
^ Seaborg, Glenn Theodore. Modern Alchemy. World Scientific. 1994: 172. ISBN 9810214405.
^ Takahashi, N. Boiling points of the superheavy elements 117 and 118. Journal of Radioanalytical and Nuclear Chemistry. 2002, 251 (2): 299–301. doi:10.1023/A:1014880730282.
^ It is debatable if the name of the group 'noble gases' will be changed if ununoctium is shown to be non-volatile.
^ Nash, Clinton S.; Bursten, Bruce E. Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118. Journal of Physical Chemistry A. 1999, 1999 (3): 402–410. doi:10.1021/jp982735k.
^ Ununoctium: Binary Compounds. WebElements Periodic Table. [2008-01-18].
^ 61.061.1 Han, Young-Kyu; Lee, Yoon Sup. Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4. Journal of Physical Chemistry A. 1999, 103 (8): 1104–1108. doi:10.1021/jp983665k.
^ Pitzer, Kenneth S. Fluorides of radon and element 118. Journal of the Chemical Society, ChemicalCommunications. 1975: 760–761. doi:10.1039/C3975000760b.
^ Ununoctium: Biological information. WebElements Periodic Table. [2008-01-18].
外部連結
维基新闻相关報導:
Controversy-Plagued Element 118, the Heaviest Atom Yet, Finally Discovered
维基共享资源中相关的多媒体资源:鿫 |
Element 118: experiments on discovery, archive of discoverers' official web page- Chemistry Blog: Independent analysis of 118 claim
- WebElements: Ununoctium
- It's Elemental: Ununoctium
- On the Claims for Discovery of Elements 110, 111, 112, 114, 116, and 118 (IUPAC Technical Report)
- "Element 118, Heaviest Ever, Reported for 1,000th of a Second", NYTimes.com.
- Eric Scerri, The Periodic Table, Its Story and Its Significance, Oxford University Press, New York, 2007.
元素周期表 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||



